Azofialová - Azo violet
 | |
| Jména | |
|---|---|
| Název IUPAC 4-[(E) - (4-Nitrofenyl) diazenyl] benzen-1,3-diol | |
| Ostatní jména (E) -4 - [(4-Nitrofenyl) diazenyl] benzen-l, 3-diol 4- (4-nitrofenyl) azobenzen-l, 3-diol Magneson I. str-Nitrofenylazoresorcinol 4-nitrofenylazoresorcinol | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.000.735 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C12H9N3Ó4 | |
| Molární hmotnost | 259 318 g mol−1 |
| Vzhled | tmavě červený až hnědý krystalický prášek |
| Hustota | 1,45 g / cm3 |
| 1 g / l H2Ó; 4 g / l ethanolu | |
| Nebezpečí | |
| Bod vzplanutí | 261,7 ° C (503,1 ° F; 534,8 K) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
| Azofialová (indikátor pH ) | ||
| pod pH 11,0 | nad pH 13,0 | |
| 11.0 | ⇌ | 13.0 |
Azofialová (4- (4-nitrofenylazo) resorcinol) (nebo p-nitrobenzeneazoresorcinol) je azosloučenina s chemický vzorec C12H9N3Ó4. Používá se komerčně jako fialové barvivo a experimentálně jako a indikátor pH, vypadající žlutě pod pH 11 a fialově nad pH 13.[1] Za přítomnosti se také změní na modrou hořčík sůl v mírně zásaditém nebo zásaditém prostředí.[2][3] Azofialová může být také použita k testování přítomnosti amonný ionty[Citace je zapotřebí ]. Barva chloridu amonného nebo hydroxid amonný Roztok se bude lišit v závislosti na použité koncentraci azofialové barvy.
Vlastnosti

Intenzivní barva, ze které sloučenina dostává svůj název, je výsledkem ozáření a následného buzení a uvolnění prodlouženého π elektron systém napříč fenoly spojenými s R-N = N-R '. Absorpce těchto elektronů klesá ve viditelné oblasti elektromagnetické spektrum. Azofialová je intenzivní indigo barva (λmax 432 nm) přibližné Pantone R: 102 G: 15 B: 240.
Syntéza
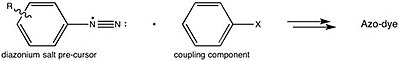
Azofialová může být syntetizována reakcí 4-nitroanilin s kyselina dusitá (generováno in situ s kyselina a a dusitany sůl ) k výrobě a diazonium středně pokročilí. Na to se potom reaguje resorcinol rozpuštěný v a hydroxid sodný řešení, prostřednictvím azo vazba reakce.
To je v souladu s obecnou strategií pro přípravu azobarviva.
Reaktivita
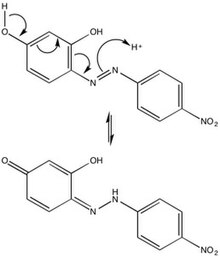
Chemický charakter azofialky lze připsat její azoskupině (-N = N-), šestičlenným kruhům a postranním hydroxylovým skupinám. Díky sterickým odpudům je azofialová nejstabilnější v trans-konfigurace, ale izomerizace azo barviv ozářením není neobvyklé. The odst-pozice tautomerizace azofialové poskytuje mechanický vhled do chování sloučeniny v kyselém prostředí, a tedy její použití jako zásadité indikátor pH.
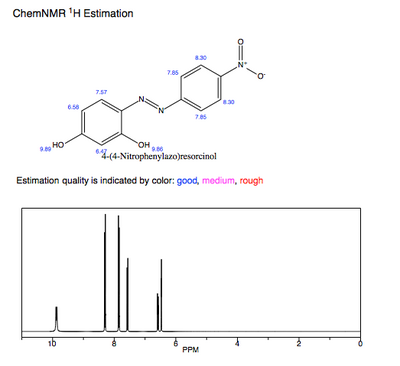
Předpovězeno 1H-NMR čisté azofialové barvy nejvíce ukazuje hydroxylové protony stíněný a kyselé protony. Účast elektronů těchto hydroxylových skupin na elektronovém konjugovaném systému π také ovlivňuje λ azofialovémax a strK.A hodnota.
Reference
- ^ „Azo Violet 25GM from Cole-Parmer“. Cole-Parmer. Archivovány od originál dne 28. října 2016. Citováno 28. října 2016.
- ^ Feigl, F .; Anger, V. (2012-12-02). Bodové testy v anorganické analýze. Elsevier. ISBN 9780444597984.
- ^ Gopalan, R. (01.01.2009). Anorganická chemie pro vysokoškoláky. Univerzity Press. ISBN 9788173716607.