Adiabatická teplota plamene - Adiabatic flame temperature - Wikipedia
Ve studii o spalování, existují dva typy adiabatická teplota plamene v závislosti na tom, jak je proces dokončen: konstantní objem a konstantní tlak; oba popisují teplotu, kterou mohou produkty spalování teoreticky dosáhnout, pokud nedojde ke ztrátě energie do vnějšího prostředí.[je zapotřebí objasnění ]
The konstantní objem adiabatická teplota plamene je teplota, která je výsledkem úplného procesu spalování, ke kterému dochází bez jakéhokoli práce, přenos tepla nebo změny v kinetický nebo potenciální energie. Jeho teplota je vyšší než konstantní tlak proces, protože se nepoužívá žádná energie ke změně objemu systému (tj. generování práce).
Společné plameny
V každodenním životě je velká většina plamenů, s nimiž se člověk setká, plameny způsobené rychlým oxidace z uhlovodíky v materiálech jako dřevo, vosk, Tlustý, plasty, propan, a benzín. Teplota adiabatického plamene za stálého tlaku těchto látek ve vzduchu je v relativně úzkém rozmezí kolem 1950 ° C. Je to proto, že z hlediska stechiometrie, spalování organické sloučeniny s n uhlíky zahrnuje rozbití zhruba 2n Vazby C – H, n Dluhopisy CC, a 1.5n Ó2 zhruba se tvoří vazby n CO2 molekuly a n H2O molekuly.
Protože většina spalovacích procesů, které se přirozeně vyskytují na čerstvém vzduchu, neexistuje nic, co omezuje plyn na určitý objem, jako je například válec v motoru. Ve výsledku budou tyto látky hořet při konstantním tlaku, což umožní plynu během procesu expandovat.
Běžné teploty plamene
Za předpokladu počátečních atmosférických podmínek (1 bar a 20 ° C), následující tabulka[1] uvádí teplotu plamene pro různá paliva za podmínek konstantního tlaku. Zde uvedené teploty jsou pro a stechiometrický oxidant paliva směs (tj. poměr ekvivalence φ = 1).
Upozorňujeme, že se jedná o teoretické, nikoli skutečné teploty plamene produkované plamenem, který neztrácí teplo. Nejbližší bude nejteplejší část plamene, kde je nejúčinnější spalovací reakce. To také předpokládá úplné spalování (např. Dokonale vyvážený, nekouřový, obvykle namodralý plamen).
| Palivo | Oxidační činidlo | ||
|---|---|---|---|
| (° C) | (° F) | ||
| Acetylén (C2H2) | Vzduch | 2500 | 4532 |
| Kyslík | 3480 | 6296 | |
| Butan (C4H10) | Vzduch | 1970 | 3578 |
| Kyanogen (C2N2) | Kyslík | 4525 | 8177 |
| Dikyanoacetylen (C4N2) | Kyslík | 4990 | 9010 |
| Etan (C2H6) | Vzduch | 1955 | 3551 |
| Ethanol (C 2H 5ACH) | Vzduch | 2082 | 3779[2] |
| Benzín | Vzduch | 2138 | 3880[2] |
| Vodík (H2) | Vzduch | 2254 | 4089[2] |
| Hořčík (Mg ) | Vzduch | 1982 | 3600[3] |
| Metan (CH4) | Vzduch | 1963 | 3565[4] |
| Methanolu (CH4Ó ) | Vzduch | 1949 | 3540[4] |
| Zemní plyn | Vzduch | 1960 | 3562[5] |
| Pentan (C5H12) | Vzduch | 1977 | 3591[4] |
| Propan (C3H8) | Vzduch | 1980 | 3596[6] |
| Methylacetylen (C3H4; MAPP plyn[je zapotřebí objasnění ]) | Vzduch | 2010 | 3650 |
| Kyslík | 2927 | 5301 | |
| Toluen (C7H8) | Vzduch | 2071 | 3760[4] |
| Dřevo | Vzduch | 1980 | 3596 |
| Petrolej | Vzduch | 2093[7] | 3801 |
| Lehký topný olej | Vzduch | 2104[7] | 3820 |
| Střední topný olej | Vzduch | 2101[7] | 3815 |
| Těžký topný olej | Vzduch | 2102[7] | 3817 |
| Asfaltové uhlí | Vzduch | 2172[7] | 3943 |
| Antracit | Vzduch | 2180[7] | 3957 |
| Kyslík | ≈3500[8] | ≈6332 | |
| Hliník | Kyslík | 3732 | 6750[4] |
| Lithium | Kyslík | 2438 | 4420[4] |
| Fosfor (bílý) | Kyslík | 2969 | 5376[4] |
| Zirkonium | Kyslík | 4005 | 7241[4] |
Termodynamika

Z první zákon termodynamiky pro uzavřený reakční systém, který máme,
kde, a jsou teplo a práce přenášené ze systému do okolí během procesu, a a jsou vnitřní energie reaktantů a produktů. V případě adiabatického plamene s konstantním objemem se objem systému udržuje konstantní, takže nedochází k žádné práci,
a nedochází k žádnému přenosu tepla, protože proces je definován jako adiabatický: . Výsledkem je, že vnitřní energie produktů se rovná vnitřní energii reaktantů: . Protože se jedná o uzavřený systém, je hmotnost produktů a reaktantů konstantní a první zákon lze zapsat na základě hmotnosti,
- .

V případě adiabatického plamene s konstantním tlakem se tlak systému udržuje konstantní, což vede k následující rovnici pro práci,
Opět nedochází k žádnému přenosu tepla, protože proces je definován jako adiabatický: . Od prvního zákona zjistíme, že
Připomínáme si definici entalpie, kterou obnovujeme: . Protože se jedná o uzavřený systém, je hmotnost produktů a reaktantů konstantní a první zákon lze zapsat na základě hmotnosti,
- .
Vidíme, že teplota adiabatického plamene procesu s konstantním tlakem je nižší než teplota procesu s konstantním objemem. Je to proto, že část energie uvolněné během spalování jde do změny objemu řídicího systému.
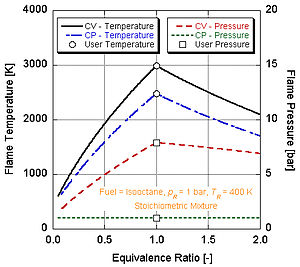
Pokud uděláme předpoklad, že spalování skončí (tj. CO
2 a H
2Ó), můžeme adiabatickou teplotu plamene vypočítat ručně buď na stechiometrický podmínky nebo chudá stechiometrie (přebytečný vzduch). Je to proto, že existuje dostatek proměnných a molárních rovnic k vyvážení levé a pravé strany,
Bohatá stechiometrie není dostatek proměnných, protože spalování nemůže být dokončeno přinejmenším CO a H
2 potřebné pro molární rovnováhu (jedná se o nejčastější neúplné produkty spalování),
Pokud však zahrneme Reakce posunu vodního plynu,
a použijeme pro tuto reakci rovnovážnou konstantu, budeme mít dostatek proměnných k dokončení výpočtu.
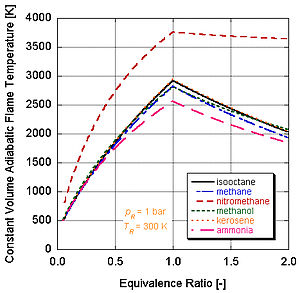
Různá paliva s různými úrovněmi energie a molárními složkami budou mít různé teploty adiabatického plamene.
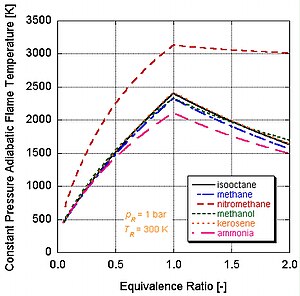
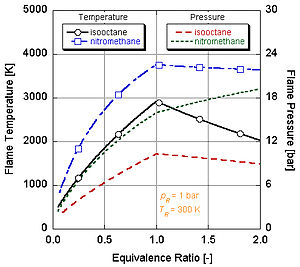
Na následujícím obrázku vidíme proč nitromethan (CH3NE2) se často používá jako zvýšení výkonu pro automobily. Jelikož každá molekula nitromethanu obsahuje dva atomy kyslíku, může hořet mnohem žhavěji, protože spolu s palivem poskytuje své vlastní oxidační činidlo. To mu zase umožňuje vytvářet větší tlak během procesu konstantního objemu. Čím vyšší je tlak, tím větší síla na píst vytváří více práce a více výkonu v motoru. Zůstává relativně horká a bohatá na stechiometrii, protože obsahuje vlastní oxidační činidlo. Neustálý chod motoru na nitromethanu však nakonec kvůli této vyšší teplotě roztaví píst a / nebo válec.

V reálných aplikacích se úplné spalování obvykle nevyskytuje. Diktuje to chemie disociace a kinetika změní relativní složky produktů. Existuje celá řada programů, které mohou vypočítat teplotu adiabatického plamene s přihlédnutím k disociaci prostřednictvím rovnovážných konstant (Stanjan, NASA CEA, AFTP). Následující obrázek ukazuje, že účinky disociace mají tendenci snižovat teplotu adiabatického plamene. Tento výsledek lze vysvětlit prostřednictvím Le Chatelierův princip.
Viz také
Reference
- ^ Viz níže v části „Tabulky“ v externích referencích.
- ^ A b C Analýza teploty plamene a emise NOx pro různá paliva
- ^ „Archivovaná kopie“. Archivovány od originál dne 2017-09-17. Citováno 2017-09-17.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ A b C d E F G h CRC Handbook of Chemistry and Physics, 96. vydání, str. 15-51
- ^ North American Combustion Handbook, svazek 1, 3. vydání, North American Mfg Co., 1986.
- ^ „Archivovaná kopie“ (PDF). Archivovány od originál (PDF) dne 24. 09. 2015. Citováno 2013-05-19.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ A b C d E F Prezentace v Power Pointu: Teplota plamene, Hsin Chu, Katedra environmentálního inženýrství, Národní univerzita Cheng Kung, Tchaj-wan
- ^ Analýza energetického cyklu spalování na kyslík a palivo s využitím tlakové spalovací komory autor: Jongsup Hong et al., MIT, který cituje Zvláštní zpráva IPCC o zachycování a skladování oxidu uhličitého (PDF). Mezivládní panel o změně klimatu. 2005. s. 122.. Zpráva IPCC však ve skutečnosti dává mnohem méně přesné tvrzení: „Přímé spalování paliva a kyslíku se mnoho let praktikuje v metalurgickém a sklářském průmyslu, kde hořáky pracují za téměř stechiometrických podmínek s plamenem až do 3 500 ° C.“ Teplota může záviset na tlaku, protože při nižším tlaku dojde k větší disociaci produktů spalování, což znamená nižší adiabatickou teplotu.
externí odkazy
Obecná informace
- Babrauskas, Vytenis (2006-02-25). "Teploty v plamenech a ohni". Fire Science and Technology Inc.. Archivovány od originál dne 12. ledna 2008. Citováno 2008-01-27.
- Výpočet teploty adiabatického plamene
- Adiabatická teplota plamene
Tabulky
- "Adiabatická teplota plamene". The Engineering Toolbox. Archivováno z původního dne 28. ledna 2008. Citováno 2008-01-27. adiabatická teplota plamene vodíku, metanu, propanu a oktanu s kyslíkem nebo vzduchem jako oxidačními činidly
- "Teploty plamene pro některé běžné plyny". The Engineering Toolbox. Archivováno z původního dne 7. ledna 2008. Citováno 2008-01-27.
- Teplota modrého plamene a běžných materiálů
Kalkulačky
- Online adiabatická kalkulačka teploty plamene použitím Cantera
- Adiabatický program teploty plamene
- Gaseq, program pro provádění výpočtů chemické rovnováhy.
- Kalkulačka teploty plamene - Adiabatické spalování bipropellantu s konstantním tlakem
- Adiabatická kalkulačka teploty plamene



















