Acyloin - Acyloin

Acyloiny nebo a-hydroxyketony[1] jsou třídou organické sloučeniny které všechny mají a hydroxyskupina sousedící s a ketonová skupina. Pojmenovaný acyloin je odvozen od skutečnosti, že jsou formálně odvozeny z redukční vazby karboxylových acylových skupin.[2]
Syntéza
Pro syntézu acyloinů existují klasické organické reakce.
- The kondenzace acyloinu je redukční vazba esterů
- The kondenzace benzoinu je kondenzační reakce mezi aldehydy katalyzovaná a nukleofil
- Oxidace karbonyly je možné s molekulárním kyslíkem, ale není selektivní
- Lepší alternativou je oxidace odpovídajících silyl enoletherů s mCPBA v Oxidace Rubottomu
- MoOPH oxidace karbonyly je systém s molybden peroxid, pyridin a hexamethylfosforamid.
Oxidace enolátu sulfonyloxaziridiny
Enoláty může být oxidován sulfonyloxaziridiny.[3][4] Enolát reaguje nukleofilní posun na elektronově deficitním kyslíku oxaziridinového kruhu.
Tento typ reakce je rozšířen na asymetrická syntéza použitím chirální oxaziridiny odvozené od kafr (kafrsulfonyl oxaziridin). Každý izomer poskytuje exkluzivní přístup k jednomu ze dvou možných enantiomery. Tato úprava je aplikována na Holtonova taxolová celková syntéza.
V enolátové oxidaci cyklopentaenonu níže[5] s jedním enantiomerem kafru, trans izomer je získán, protože přístup k hydroxylové skupině v cis pozice je omezená. Použití standardního oxaziridinu nevedlo k acyloinu.
Reakce
- Snížení acyloiny dávají dioly.
- Oxidace acyloiny dávají diones.
- α-hydroxyketony dávají pozitivní Tollensovy a Fehlingův test.
- Některé acyloiny se přeskupují s pozicemi vyměněnými pod vlivem základny v Lobry – de Bruyn – van Ekensteinova transformace
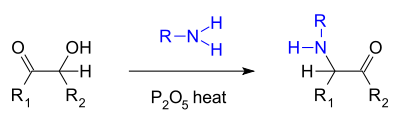
- Podobnou reakcí je tzv Voigtova aminace[6] kde acyloin reaguje s primárním amin a oxid fosforečný na α-keto amin:[7]
- Syntéza indolu,[8] porovnat Bischler – Möhlau
Viz také
- Glycolaldehyd příbuzná molekula ekvivalentní acyloinu s oběma skupinami R jako vodík (a tedy aldehyd, nikoli keton)
Reference
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “acyloiny ". doi:10.1351 / goldbook.A00126
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “acyloiny ". doi:10.1351 / goldbook.A00126
- ^ Davis, Franklin A .; Vishwakarma, Lal C .; Billmers, Joanne G .; Finn, John (1984). „Syntéza a-hydroxykarbonylových sloučenin (acyloiny): přímá oxidace enolátů za použití 2-sulfonyloxaziridinů“. J. Org. Chem. 49 (17): 3241–3243. doi:10.1021 / jo00191a048.
- ^ Davis, F. A .; Haque, M. S .; Ulatowski, T. G .; Towson, J. C. (1986). „Asymetrická oxidace esterových a amidových enolátů za použití nových (kafrylsulfonyl) oxaziridinů“. J. Org. Chem. 51 (12): 2402. doi:10.1021 / jo00362a053.
- ^ A b Hughes, Chambers C .; Miller, Aubry K .; Trauner, Dirku (2005). „Elektrochemický přístup k guanacastepenům“ (PDF). Org. Lett. 7 (16): 3425–3428. doi:10,1021 / ol047387l. PMID 16048308. Archivovány od originál (PDF) dne 4. září 2006.
- ^ von Meyer, E .; Voigt, Karl (1886). „Ueber die Einwirkung von primären aromatischen Aminen auf Benzoïn“ [O účinku primárních aromatických aminů na benzoin]. J. Prakt. Chem. (v němčině). 34 (1): 1–27. doi:10.1002 / prac.18860340101.
- ^ Lawrence, Stephen A. (2004). Aminy: Syntéza, vlastnosti a aplikace. Cambridge University Press. ISBN 978-0-521-78284-5.
- ^ Roth, Lepke (1972). „Synthese von Indol- und Carbazol-Derivaten aus a-Hydroxyketonen und aromatischen Aminen“ [Syntéza indolových a karbazolových derivátů z a-hydroxyketonů a aromatických aminů]. Archiv der Pharmazie (v němčině). 305 (3): 159–171. doi:10,1002 / ardp.19723050302.

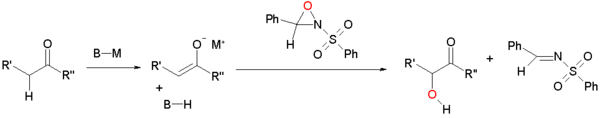

![Příklad oxidace enolátu [5]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/02/Acyloin_example_Hughes.png/500px-Acyloin_example_Hughes.png)