Vankosamin - Vancosamine
 Zobrazení cyklohexanu a křesla vankosaminu (nahoře) a epivankosaminu (dole). Všimněte si odlišného stereocentra na uhlíku 4. | |
| Jména | |
|---|---|
| Název IUPAC (3S,4S,5S) -3-Amino-4,5-dihydroxy-3-methylhexanal | |
| Ostatní jména 3-Amino-2,3,6-trideoxy-3-methyl-L-lyxo-hexopyranóza | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C7H15NÓ3 | |
| Molární hmotnost | 161.201 g · mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Vankosaminy jsou aminocukry které jsou součástí vankomycin a další molekuly v rámci rodiny vankomycinových antibiotik. Syntéza vankosaminu je kódována vankomycinem (vps) biosyntetický shluk. Epivankosamin, blízce příbuzný aminocukor, je kódován chloreremomycinem (cep) biosyntetický shluk.[1]
Dějiny
Vankosamin byl nejprve izolován Lomakinou et al v roce 1968.[2] V roce 1972 Johnson et al jako první identifikovali a zcela charakterizovali vankosamin.[3] Epivankosamin byl následně izolován v roce 1988 Huntem et al na Eli Lilly[4]
Biosyntéza
Biosyntéza vankosaminu a epivankosaminu je identická, s výjimkou posledního kroku.[5] Enzymy, které katalyzují reakce, byly označeny EvaA-E. Molekula TDP-D-glukózy vstupuje do dráhy přeměnou na molekulu 1 pomocí enzymu oxidoreduktázy a poté enzymu dehydratázy. V dalším kroku EvaA dehydratuje molekulu 1 deprotonací na 3-C za vzniku a enolátu, který pak eliminuje 2-OH, za vzniku molekuly 2. Molekula 2 je transformována na molekulu 3 tautomerizace do své keto formy a poté bytí transaminovaný pomocí aplikace EvaB L-Glu jako zdroj amoniaku a PLP jako kofaktor.
 Biosyntéza vankosaminu, část 1
Biosyntéza vankosaminu, část 1
EvaC poté methyláty molekulu 3 na 3-C za vzniku molekuly 4 deprotonací za vzniku enolátového meziproduktu, který pak napadne SAM methylová skupina v aktivním místě EvaC. EvaD poté epimerizuje molekulu 4 při 5-C za vzniku molekuly 5. Nakonec může EvaE tvořit buď epi / vankosamin redukcí použitím buď NADH nebo NADPH ke snížení karbonylu při 4 ° C. Stereochemický výsledek závisí na EvaE, která je zakódována v biosyntetickém klastru. Vankomycin vps Výsledkem EvaE je vankosamin, zatímco chloroeremomycin cep Výsledkem přípravku EvaE je epivankosamin.
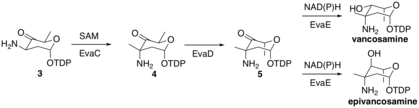 Biosyntéza vankosaminu, část 2
Biosyntéza vankosaminu, část 2
Vankosaminy jsou pak buňkou použity k syntéze vankomycinu a příbuzných molekul. Glykosyltransferáza váže amino cukr přes a-1 etherové vazby.
Na aminoskupině 3-C jsou možné další modifikace N-alkyl nebo N-acyl deriváty tohoto cukru.
Celková syntéza
Bylo publikováno několik syntéz vankosaminu.[6][7][8]
Viz také
Reference
- ^ Yim, G., Thaker, M. N., Koteva, K., Wright, G. "Glykopeptidová antibiotická biosyntéza." The Journal of Antibiotics, 2017, 67, 31-41.
- ^ Lomakina, N. N., Spiridonova, I. A., Bognár, R., Puksás, M., Sztaricskai, F. Antibiotiki. 1968, 13, 975.
- ^ Johnson, A. W., Smith, R. M., Guthrie, R. D. „Vancosamin: Struktura a konfigurace nového aminocukru z vankomycinu.“ J. C. S. Perkin I., 1972, 2153-2159.
- ^ Hunt, A. H., Molloy, R. M., Debono, M., Occolowitz, J. L. "Izolace a charakterizace 4-epi-vankosaminu." Tetrahedron Lett, 1988, 29, 1223-1226.
- ^ Chen, H., Thomas, M. G., Hubbard, B. K., Losey, H. C., Walsh, C. T., Burkart, M. D. „Deoxysugary v glykopeptidových antibiotikách: Enzymatická syntéza TDP-L-epivankosaminu v biosyntéze chloreremomycinu.“ PNAS, 2000, 97 (22), 11942-11947
- ^ Hauser, F. M., Ellenberger, S. R., Glusker, J. P., Smart, F. J., Carrell, H. L. „Stereoselective Syntheses or +/- Daunosamine, +/- Vancosamine, and +/- Ristosamine from Acyclic Precursors.“ J. Org. Chem. 1986, 51, 50-57.
- ^ Nicolaou, K. C., Mitchell, H. J., van Delft, F. L., Rübsam, F., Rodrígruez, R. M. „Expeditious Routes to Evernitrose and Vancosamine Derivatives and Synthesis or a Model Vancomycin Aryl Glycoside.“ Angew. Chem. Int. Vyd. 1998, 37, Č. 13/14, 1871-1874.
- ^ Parker, K. A., Chang, W. „Syntéza derivátů L-vankosaminu z prekurzorů ne-sacharidů krátkou sekvencí na základě Marshallových, McDonaldových a Du Boisových reakcí.“ Org. Lett. 2003, 5 (21), 3891-3893.


