Ultrasonografie jaterních nádorů - Ultrasonography of liver tumors - Wikipedia
tento článek potřebuje víc lékařské odkazy pro ověření nebo se příliš spoléhá na primární zdroje. (Srpna 2020) |
| Ultrasonografie jaterních nádorů | |
|---|---|
| Účel | detekce a charakterizace jaterních nádorů |
Ultrasonografie jaterních nádorů zahrnuje dvě fáze: detekci a charakterizaci.[Citace je zapotřebí ]
Detekce nádoru je založena na výkonu metody a měla by zahrnovat morfometrické informace (rozměry tří os, objem) a topografické informace (počet, umístění specifikující jaterní segment a lalok / laloky). Specifikace těchto údajů je důležitá pro staging jaterních nádorů a prognózu.[Citace je zapotřebí ]
Charakterizace nádoru je složitý proces založený na souhrnu kritérií vedoucích k definici povahy nádoru. Další diagnostické postupy, zejména intervenční, již často nejsou nutné. Charakterizace nádoru pomocí ultrazvuk metoda bude založena na následujících prvcích: konzistence (pevná, kapalná, smíšená), echogenicita, vzhled struktury (homogenní nebo heterogenní), vymezení sousedního jaterního parenchymu (kapsulární, nepřesné), pružnost, účinek na zadní akustické zesílení, vztah se sousedními orgány nebo strukturami (posunutí, invaze), vaskulatura (přítomnost a charakteristiky na Dopplerova ultrasonografie a kontrastní ultrazvuk (CEUS).[Citace je zapotřebí ]
Přidá se také substrát, na kterém se nádorový stav vyvíjí (pokud jsou játra normální nebo pokud existují známky difúzního onemocnění jater) a vývojový kontext (onkologický, septický). Zvláštní pozornost je třeba věnovat analýze oběhového lůžka. Mikrocirkulační vyšetření umožňuje diskriminaci mezi benigními a maligními nádory. Charakteristickými prvky maligní cirkulace jsou vaskulární hustota, přítomnost cév s nepravidelnými cestami a velikostí, některé z nich komunikují, jiné jsou nakonec blokovány „rukavicovým prstem“, přítomnost arterio-arteriálních a arterio-venózních zkratů, nedostatek nebo nekompetentnost arteriální prekapilární svěrač složený z hladkých svalů.[Citace je zapotřebí ]Diagnostika a charakterizace jaterních nádorů vyžaduje odlišný přístup pro každou skupinu podmínek s využitím výše popsaných postupů pro každou z nich. Korelace s anamnézou, klinickým a funkčním (biochemickým ahematologickým) stavem pacienta jsou důležitými prvky, které je rovněž třeba vzít v úvahu.[Citace je zapotřebí ]
Benigní nádory jater
Benigní jaterní nádory obecně se vyvíjejí na normálních nebo tučných játrech, jsou jednoduchá nebo mnohonásobná (obecně vajcovitá), mají výrazné vymezení, se zvýšenou echogenitou (hemangiomy, benigokální nodulární hyperplazie) nebo chybí, se zadním zesílením akustického účinku (cysty), mají výrazné vymezení (hydatidová cysta), nedostatek vaskularizace nebo vykazují charakteristický oběhový vzor, vytěsňují normální jaterní struktury a dokonce i sousední orgány (v případě velkých velikostí), jsou docela elastické a nepronikají do jaterních cév. Pacient má dobrý celkový stav, protože nádory jsou často asymptomatické a jsou náhodně objeveny.[Citace je zapotřebí ]
Jaterní cysty
Mohou být jednoduché nebo vícenásobné, s proměnlivou velikostí, obvykle menší než 20 mm (vrozené). Vzácně mohou velikosti dosáhnout několika centimetrů, což vede k nahrazení celého jaterního laloku (získaného, parazitického). Mohou být spojeny s renálními cystami; v tomto případě má choroba dědičný autozomálně dominantní přenos (von Hippel Lindauova choroba).[Citace je zapotřebí ]
Ultrazvukový vzhled je dobře definovaná léze, s velmi tenkými, téměř nezjistitelnými stěnami, bez oběhového signálu při vyšetření pomocí Dopplera nebo CEUS. Obsah je izraelský, což naznačuje tekuté složení. Přítomnost membrán, hojné sedimentační cysty uvnitř je sugestivní pro parazitickou, hydatidovou povahu. Je vidět zadní část léze, jev zesílení zvuku, který posiluje podezření na tekutinu. Obvykle vytlačují normální jaterní cévy, ale nedochází k vaskulární nebo biliární invazi.[Citace je zapotřebí ]
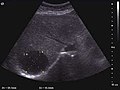
Jaterní cysta[Citace je zapotřebí ]
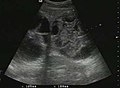
Hydatidová jaterní cysta. Diagnostickými kritérii jsou přítomnost membrán a sedimentů uvnitř.[Citace je zapotřebí ]
Hemangiom


Jedná se o nejčastější nádor jater s prevalencí 0,4 - 7,4%. Je obecně asymptomatická, ale může být také spojena s potížemi s bolestí nebo s cytopenie a / nebo oranemií, pokud je velmi objemná. Je jedinečný nebo paucilokulární. Může být spojen s jinými typy benigních jaterních nádorů. Charakteristický 2D ultrazvukový vzhled je velmi dobře definovanou lézí o velikosti 2–3 cm nebo menší, která vykazuje zvýšenou echogenitu a při umístění do kontaktu s bránicí lze pozorovat fenomén „zrcadlového obrazu“. Při palpaci jater převodníkem je hemangiom stlačitelný a posílá dozvuky dozadu. Dopplerův průzkum neodhalil žádný oběhový signál kvůli nízké rychlosti proudění. Vyšetření CEUS má skutečnou diagnostickou hodnotu díky typickému chování progresivního CA zesílení nádoru z periferie směrem do centra. Vylepšení je pomalé, během několika minut, v závislosti na velikosti hemangiomu a na přítomnosti (nebo nepřítomnosti) vnitřní trombózy. Během pozdní (sinusové) fáze, je-li zcela „naplněn“ CA, se hemangiom v játrech jeví jako izoechogenní. Odchylky od výše popsaného chování se mohou vyskytnout u arterializovaných hemangiomů nebo u těch, které obsahují arterio-venózní zkraty. V těchto případech je diferenciace od maligního nádoru obtížná a vyžaduje další zobrazovací postupy, sledování a měření krátkých časových intervalů nádoru.[1]
Fokální nodulární hyperplazie

Jedná se o nádor vyvinutý sekundárně po oběhové anomálii s hojnými arteriálními cévami, které mají charakteristické místo ve středu nádoru, uvnitř fibrotické jizvy. Z této úrovně se vyvíjí síť aradiálních plavidel s periferní orientací. Cirkulační lůžko nádoru je bohaté na mikrocirkulační a portální žilní prvky. Výskyt je vyšší u mladších žen a vývoj nádoru je urychlen užíváním perorální antikoncepce. 2D ultrazvukový vzhled je poměrně dobře definovaná hmota, s proměnnými velikostmi, obvykle jednou, pevnou konzistencí s nehomogenní strukturou. Zřídka lze centrální jizvu rozlišit. Spektrální dopplerovské vyšetření detekuje centrální arteriální cévy a CFMexploration odhalí jejich radiální polohu. Vyšetření CEUS ukazuje centrální nádorové naplnění oběhového lůžka během arteriální fáze a úplné zlepšení během portální venózní fáze. Během této fáze se centrum léze stává hypoechoickým, což zvyšuje tumorcar. Během pozdní fáze zůstává nádor izoechoický pro játra, což posiluje diagnostiku benigních lézí.[Citace je zapotřebí ]
Adenom
Jedná se o benigní nádor tvořený normálními nebo atypickými hepatocyty. Má incidenci 0,03%. Jeho vývoj je vyvolán příjmem anabolických hormonů a perorálních kontraceptiv. Nádor je asymptomatický, ale může být spojen s bolestmi pravého horního kvadrantu v případě vnitřního krvácení. 2D ultrazvuk ukazuje dobře definovanou, nezapouzdřenou pevnou hmotu. V případě intratumorálního krvácení může mít heterogenní strukturu. Dopplerovské vyšetření nevykazuje žádný oběhový signál. Průzkum CEUS je poměrně nejednoznačný a nemůže vždy stanovit diferenciální diagnózu s hepatocelulárním karcinomem. Během arteriální fáze tedy dochází k dostředivému a nehomogennímu vylepšení. Během portální venózní fáze dochází k mírnému vymývání. Během pozdní fáze je vzhled izoechový nebo hypopoechový, kvůli nedostatku Kupfferových buněk.[Citace je zapotřebí ]
Maligní nádory jater
Maligní jaterní nádory se vyvíjejí na cirhotických játrech (hepatocelulární karcinom, HCC) nebo na normálních játrech (metastázy). Jsou jednoduché nebo vícenásobné (zejména metastázy), mají proměnlivé, obecně nepřesné vymezení, mohou mít velmi výrazný oběhový signál (hepatocelulární karcinom a některé typy metastáz), mají heterogenní strukturu (výsledek intratumorálních poruch oběhu, důsledek krvácení nebo nekrózy) a jsou pevné na dotek, dokonce tuhé. Celkový stav pacienta koreluje se základním onemocněním (vaskulární a parenchymální dekompenzace jaterní cirhózy, úbytek hmotnosti, nedostatek chuti k jídlu a anémie s rakovinou).[Citace je zapotřebí ]
Hepatocelulární karcinom (HCC)
Je to nejčastější malignita jater. Vyvíjí sekundární tocirhosis, proto je ultrazvukové vyšetření každých 6 měsíců v kombinaci s určením alfa fetoproteinu (AFP) účinnou metodou pro včasnou detekci a monitorování léčby tohoto typu nádoru. Klinicky se HCC překrývá s pokročilou cirhózou jater (dlouhá evoluce, opakovaná dekompenzace cév a parenchymů, někdy krvácení v důsledku úniku varixů) kromě zrychleného úbytku hmotnosti v nedávné minulosti a nedostatku chuti k jídlu.[Citace je zapotřebí ]

Vzhled HCC na 2D ultrazvuku je vzhled solidního nádoru s nepřesným vymezením, s heterogenní strukturou, uni- nebo multilokulárně (encefaloidní forma). Je také popsán „infiltrační“ typ, který je obtížné odlišit od jaterní nodulární rekonstrukce u cirhózy. Typicky HCC napadá jaterní cévy, především portální žíly, ale také jaterní žíly. Dopplerovské vyšetření detekuje vysokorychlostní arteriální průtok a nízký index impedance (v korelaci s popsanými změnami v angiogenezi nádoru). Prostorové rozložení cév je nepravidelné, neuspořádané. Vyšetření CEUS ukazuje hypertenzi léze během arteriální fáze. Během portální žilní fáze dochází ke specifickému „vymývání“ ultrazvukového kontrastního činidla (UCA) a v pozdní fázi se nádor jeví jako hypoechoický. Špatně diferencované nádory mohou mít silnější vymývání, což vede k izoechoickému vzhledu jaterního parenchymu během fáze portální žíly. Tento vzhled byl nalezen v cca. 30% případů. Popsané změny mají diagnostickou hodnotu v jaterních uzlinách větších než 2 cm.[Citace je zapotřebí ]
Ultrazvuk je užitečný při detekci, stadializaci a hodnocení terapeutické účinnosti HCC. Pokud jde o staging týkající se účinnosti terapie, používá se barcelonská klasifikace, která identifikuje pět stádií HCC. Léčebná terapie je indikována v časných stádiích, která zahrnují velmi časné stádium (jediný uzlík <2 cm), léčitelné chirurgickou resekcí (přežití 50-70% pět let po chirurgické resekci) a časné stádium (jednotlivý uzlík 2–5 cm nebo více až 3 uzliny <3 cm), které lze léčit radiofrekvenční ablací (RFA) a transplantací jater. Intermediální fáze (polinodulární, bez portální invaze) a pokročilá fáze (N1, M1, s portální invazí) podopaliativní terapie (TACE a systémová terapie sorafenibem) a v konečné fázi platí pouze symptomatická léčba.[Citace je zapotřebí ]
Cholangiokarcinom
Vyvíjí se na necirhotických játrech. Vzhled 2D ultrazvuku je netypický - pevná hmota s heterogenní strukturou, špatně vymezená, často s periferním umístěním a slabým signálem oběhu. Vyšetření CEUS odhalilo mírné zvýšení periferní tkáně tumoru během arteriální fáze s následným vymýváním během portální venózní fáze a hypoechoickým vzhledem během pozdní fáze.[Citace je zapotřebí ]
Metastázy v játrech
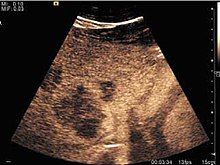

K detekci jaterních metastáz u pacientů s onkologickou anamnézou je nutné americké vyšetření. Navíc může metoda náhodně detekovat metastázy u asymptomatických pacientů. Včasná identifikace (malé velikosti, malý počet) je důležitá pro stanovení optimálního průběhu léčby, který může být složitý (chemoterapie, radiofrekvenční ablace, chirurgická resekce), ale vítaný. Kromě toho je také důležitá diskriminace synchronních lézí, které mají odlišnou povahu, s vědomím, že až 25–50% jaterních lézí menších než 2 cm detekovaných u pacientů s rakovinou může být benigních. Citlivost USA na detekci metastáz se liší v závislosti na zkušenostech zkoušejícího a použitém vybavení a pohybuje se mezi 40–80%. Citlivost je podmíněna velikostí a akustickou impedancí uzlů. U průměru léze pod 10 mm je přesnost USA skvěle snížena a dosahuje cca. 20%. Dalšími prvky, které přispívají ke snížení výkonnosti USA, jsou: nadměrná obezita, tučné onemocnění jater, hypomobilita bránice a určité vzorce hyperechoických nebo izoechoických metastáz, které lze přehlédnout nebo mohou napodobovat benigní stavy. Konvenční výskyt metastáz v USA je netypický, sestává z ohraničených lézí, s jasným, nepřesným nebo „halo“ vymezením, s homogenním nebo heterogenním vzorem ozvěny. Mohou být jednoduché (často jaterní metastázy z tlustého střeva) nebo vícečetné. Echogenita je proměnlivá. Když se zvýší, mohou komprimovat žlučovody (které mohou být rozšířené) a jaterní cévy. Postižení jater může být segmentové, lobární nebo generalizované. V této situaci dochází k výrazné hepatomegalii. Obecně mají metastázy, s několika výjimkami (karcinoidmetastázy), necharakteristický Dopplerův vaskulární vzorec. Metastázy cyst-adenokarcinomu způsobené obsahem semifluidu mohou mít atransonický vzhled. Při růstu mohou vést k centrální nekróze. Vyšetření CEUS je skutečným průlomem v detekci a charakterizaci jaterních metastáz.[Citace je zapotřebí ]
Zvýšený výkon je založen na identifikaci specifických vaskulárních vzorců během arteriální fáze a na pozorování metastáz na rozdíl od normálního jaterního parenchymu během sinusoidální fáze. Zvýšená přesnost CEUS je způsobena odlišným chováním normálního jaterního parenchymu (zachycuje CA v Kuppferových buňkách) proti nádorovému parenchymu (neobsahuje Kuppferovy buňky, proto je vzhled CEUS hypoechoický). K tomu se přidávají zvláštnosti intratumorální cirkulace představované sníženým arteriálním lůžkem ve srovnání s okolním normálním játrem a absencí portálních cév. Pokud jde o vaskularitu, mohou být metastázy hypovaskulární (v žaludku, tlustém střevě, pankreatu nebo ovariálních adenokarcinomech) s hypoechoickým charakterem během arteriální fáze a podobné během portální venózní a pozdní fáze, hypervaskulární (neuroendokrinní nádory, maligní melanom, sarkomy, nádory ledvin, prsu nebo štítné žlázy) s hyperechoickým výskytem během arteriální fáze, s vymýváním během portální žilní fáze a hypoechoickým vzorem 30 sekund po injekci.[Citace je zapotřebí ]
Použitím CEUS vyšetření k detekci metastáz se získá citlivost 80–95%, obdobně jako u kontrastní CT a MRI. Intraoperační použití postupu zvyšuje jeho výkonnost, i když nemá rozhodující příspěvek ke změně terapeutického chování. Omezení metody souvisí s penetrací USA (výrazné tukové onemocnění jater, hluboká léze, nadměrná obezita) a se zkušenostmi zkoušejícího. K tomu se přidává riziko záměny mezi hypervaskulárními metastázami, hepatocelulárním karcinomem a hemangiomem a záměnou mezi hypovaskulárními metastázami a malými jaterními cystami. Rutinní použití CEUS vyšetření k detekci jaterních metastáz je doporučeno, pokud konvenční americké vyšetření není přesvědčivé, pokud jsou nezbytné přesné informace o některých úrazech (počet, umístění) v kombinaci s kontrastní CT / MRI a pro posouzení účinnosti léčby při použití antiangiogenní terapie pro hypervaskulární metastázy. Metoda nemůže nahradit CT / MRI vyšetření, která mají dobře zavedené indikace v onkologii.
Pseudotumory a zánětlivé hmoty jater
Kromě výše uvedených entit se mohou objevit zánětlivé masy nebo dokonce pseudomasy. Jejich diagnóza je poměrně obtížná a kritéria použitá pro diferenciaci jsou často nedostatečná, vyžadující morfologické diagnostické postupy, použití jiných diagnostických zobrazovacích metod nebo čas od času přehodnocení pacienta. To zahrnuje léze vyvinuté při rekonstrukci jaterního parenchymu, ke kterým dochází při cirhóze, akumulaci steatózy nebo v případě akutních nebo chronických zánětlivých onemocnění.[Citace je zapotřebí ]
Fokální steatóza
Spočívá v lokalizované akumulaci jaterních buněk bohatých na tuky. V některých případech může tato akumulace napodobovat nádor jater. Někdy lze vidět opačný jev, a to „ostrov“ normálního parenchymu v „zářící“ játře. V obou případech ultrazvukové vyšetření identifikuje dobře definovanou, nezapouzdřenou oblast s echostrukturou a vaskulaturou podobnou jako u normálního jaterního parenchymu. Léze může mít různé formy, většinou oválné a umístěné ve IV. Segmentu, vpředu od jaterního hilu. Vyskytuje se u pacientů s dyslipidemií nebo požíváním alkoholu s normálním fyzickým a biologickým stavem. Potvrzení benigní diagnózy se provádí pomocí vyšetření CEUS, které prokazuje normální oběhové lůžko podobné přilehlému jaternímu parenchymu ve všech třech fázích vyšetřování.[Citace je zapotřebí ]
Jaterní absces

Jaterní absces má heteromorfní ultrazvukový vzhled, nejtypičtější je hromadění s nepravidelnými tvary, třásněmi, s tekutým nebo semifluidním obsahem, se vzduchem uvnitř nebo bez něj. Dopplerovské vyšetření ukazuje na nedostatek cév v lézi. Průzkum CEUS ukazuje zesílení během arteriální fáze v blízkosti léze, což naznačuje hyperparemii jater. Během venózní a sinusové fáze je obraz hypoechoický a centrální tekutina je vylepšena kontrastem. Vyšetření CEUS je užitečné, protože potvrzuje klinické podezření na absces. Kromě toho umožňuje přesné měření velikosti sbírky a indikaci týkající se její topografie uvnitř jater (lalok, segment).[Citace je zapotřebí ]
Preneoplastický stav. Cirhotické monitorování jater
Cirhotická játra jsou charakterizována výskytem uzlíků různých velikostí a stupňů vývoje, takže regenerační uzliny, dysplastické uzliny a dokonce i časný hepatocelulární karcinom mohou v určitém okamžiku během progrese onemocnění koexistovat. Existují studie, které ukazují, že 59–94% nově diagnostikovaných jaterních uzlin u pacientů s cirhózou má maligní histologii a až 50% hyperechoických lézí s ultrazvukovým výskytem hemangiomu se nakonec ukáže jako hepatocelulární karcinom. Současná praxe v mnoha centrech se proto domnívá, že jakákoli nová léze odhalená u pacienta s cirhózou by měla být považována za maligní, dokud nebude prokázáno jinak. Existují tři kategorie cirhotických jaterních uzlin: regenerační, dysplastické (považované za premaligní podmínky) a nádorové (HCC).[Citace je zapotřebí ]
Regenerativní uzliny (RN)

Tyto léze jsou dobře definované, mají isoechoický nebo hypoechoický vzhled a velikost menší než 1 cm. Mají vysoký počet a mají víceméně rovnoměrné rozdělení zahrnující všechny jaterní segmenty. Mohou se tlačit, což vede k velkým pseudo nádorům. Při dopplerovském vyšetření nemají tyto uzliny žádný oběhový signál. Průzkum CEUS je indikován, když je uzlík odlišný od obecného vzorce restrukturalizovaných jater buď jinou echogenitou nebo jinou velikostí než většina uzlů. Během arteriální fáze je signál slabý nebo nepříjemný. Během portální venózní a pozdní fáze je vzhled trvale isoechoický.[Citace je zapotřebí ]
Obecně se RN neliší od okolního parenchymu. Vyšetření CEUS je užitečné k vyloučení aktivní léze v okamžiku průzkumu, ale nemá absolutní prognostickou hodnotu; proto by měl být pacient pravidelně vyšetřován v krátkých intervalech. Je nutná korelace s klinickým stavem a měřeními AFP.[Citace je zapotřebí ]
Dysplastické uzliny (DN)

Tyto léze mají různé vzory (hypo nebo hyperechoické) s průměrem alespoň 1 cm. Jsou to hepatocyty s dysplastickými změnami, ale bez jasných histologických kritérií formálnosti. Jsou rozděleny na dysplastické uzliny nízkého stupně, kde se vyskytuje buněčná atypie a vysoce kvalitní dysplastické uzliny se středně těžkou nebo těžkou buněčnou atypií, ale bez známek malignity. Ve vysoce kvalitních dysplastických uzlinách (vzhled nazývaný „uzlík v uzlu“) lze občas identifikovat dobře diferencovaná ložiska HCC. Většina autorů přijímá proces karcinogeneze jako progresivní transformaci DN z nízkého stupně do vysokého stupně a na HCC. Vaskulatura uzlíku se mění postupně, v korelaci se stupněm malignity, a je charakterizována poklesem až do nepřítomnosti portálního žilního vstupu a zvýšením arteriálního intratumorálního vstupu. Neoformační cévy se objevují se zvyšujícím se stupněm dysplazie. Arteriálníneovaskularizace se zvyšuje chaoticky a výbušně, zatímco normální arteriální a portální vaskulatura stále klesá. Dysplastické uzliny vysoké kvality jsou hypovaskularizovány jak v arteriální, tak v portální fázi, zatímco časné HCC uzliny mohou mít podobný arteriální vzor s okolním parenchymem nebo se exacerbují a portální hypovaskularizace. U středně těžké nebo špatně diferencované HCC (klasické HCC) je výživa nádorů prováděna pouze neoformačními cévami (hojná ), normální arteriální a portální vaskulatura zcela mizí. Toto chování intratumorální vaskularizace je typické pro HCC a je klíčem k zobrazovací diagnostice.[Citace je zapotřebí ]
Ultrasonografie v režimu B nedokáže rozlišit mezi regeneračními uzlinami a hraničními lézemi, jako jsou dysplastické uzliny a dokonce ani časný HCC. Dopplerovské vyšetření má také nízkou citlivost při rozlišování dysplastických uzlin od raného HCC. Dopplersignál může chybět jak v regeneračních, tak v dysplastických uzlinách. Někteří autoři označují přítomnost Dopplerova toku venózního typu, který odráží portální venózní výživu pakodu jako charakteristický rys dysplastických uzlin a časného HCC (Minami & Kudo, 2010). Jiní autoři si všimli přítomnosti arteriálního průtoku s malými frekvenčními variacemi a normálním indexem rezistivity. Při vyšetření CEUS mohou mít RN i DN poměrně různý vzorec zesílení. Obecně se oba uzlíky shodně zlepšují s okolním jaterním parenchymem po injekci UCA. Dysplastické uzliny jsou v arteriální fázi hypovaskulární. V případě vysoce gradedysplastického uzlíku může být někdy detekována hypervaskularizace, ale bez asociovaného „vymývání“ během portální a pozdní fáze CEUS. V těchto případech může biopsie objasnit diagnózu.[Citace je zapotřebí ]
Časný hepatocelulární karcinom (časný HCC)
Sugestivní vzhled časného HCC při 2D ultrazvukovém vyšetření je hypoechoicnodule s odlišným vzorem vyvinutý na cirhotických játrech. Hypoechoický vzhled je charakteristický pro středně / špatně diferencovaný HCC s nízkými nebo chybějícími tukovými změnami. Zřídka se může HCC jevit jako izoechoický, sestává z nádorového typu s vyšším stupněm diferenciace, a proto s pomalejším vývojem. Dalším běžným aspektem je vzhled „brightloop“ nebo „nodule-in-nodule“, hypoechoické uzliny v hyperechoickém nádoru.[Citace je zapotřebí ]
Spektrální dopplerovské charakteristiky časného HCC se překrývají s charakteristikami dysplastického uzlíku, protože jsou reprezentovány přítomností typu portálního venózního signálu nebo arteriálního typu s normálním RI (dobře diferencovaný HCC) nebo zvýšeným RI (středně nebo špatně diferencovaný HCC). Průzkum CFM identifikuje chaotický vzorec plavidel.[Citace je zapotřebí ]
Při vyšetření CEUS má časný HCC během srdeční fáze iso- nebo hypervaskulární vzhled, po kterém následuje vymývání během portální žilní a pozdní fáze. Existují studie, které ukazují, že proces vymývání přímo souvisí s velikostí a vlastnostmi neoplastického oběhového lůžka. Vysoce diferencovaný HCC tedy ilustruje fenomén zpoždění nebo dokonce velmi pozdního „vymývání“, zatímco špatně diferencovaný HCC má na konci arteriální fáze zrychlené vymývání. Je proto nutné analyzovat všechny tyto tři fáze vyšetření CEUS na správnou charakteristiku jaterních uzlin. Vyplachování nádoru na konci arteriální fáze umožňuje diagnostiku HCC s předvídatelností 89,5%. Někteří autoři se domnívají, že pro diagnostiku HCC stačí včasné výrazné zlepšení kontrastu uzlíku v rozmezí 1–2 cm vyvinutého na jaterní cirhóze. Tyto výsledky dokazují, že pro správnou charakterizaci lézí je nutné prodloužit dobu vyšetření na 5 minut nebo i déle.[Citace je zapotřebí ]
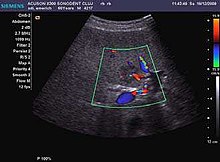

Hodnota ultrazvuku při „screeningu“ HCC
Základní 2D ultrazvuk hraje důležitou roli v programech sledování pacientů s rizikem rozvoje HCC. Vyšetření má přijatelnou citlivost, která se zvyšuje s velikostí nádoru. Citlivost se pohybuje mezi 42% u lézí <1 cm a 95% u nádorů větších než 1 cm a specificita může dosáhnout 90%. Optimální časový interval pro ultrazvukové vyšetření „rizikové“ populace je 6 měsíců, jak vyplývá z klinických studií, které zkoumaly čas zdvojnásobení velikosti nádoru (Bruix, 2005; Maruyama et al., 2008). U nově vyvinutého uzlíku budou zohledněna rozměrová kritéria. U uzlíku o velikosti menší než 10 mm bude tedy pacient každé 3 měsíce přehodnocen ultrazvukem, protože růstový trend je indikací pro dokončení vyšetřování pomocí dalších diagnostických metod. postupy; při velikosti mezi 10 - 20 mm jsou nutné dva shodné zobrazovací postupy, v případě potřeby doplněné ultrazvukem vedenou biopsií; při velikosti nad 20 mm stačí pro pozitivní diagnostiku jediná dynamická zobrazovací technika s charakteristickým vzhledem. V nejistých případech je třeba provést doplňkové dynamické zobrazovací techniky nebo biopsii. Pokud průzkum typu Doppler nestačí, provede se CEUS vyšetření. Vždy je třeba mít na paměti riziko falešně pozitivních výsledků pro HCC v případě cholangiokarcinomů, proto je třeba zvážit doplňkové diagnostické postupy.[Citace je zapotřebí ]
Účinnost screeningových programů dokazuje zvýšení míry detekce HCC <2 cm (z <5% v 90. letech v Evropě na> 30% dnes v Japonsku) s možností léčebné terapie. Hlavní problém ultrazvukového screeningu spočívá v tom, že aby byl nákladově efektivní, měl by být aplikován na běžnou populaci, a nikoli v terciárních nemocnicích. To zvyšuje důležitost části ultrazvukového vyšetření závislé na operátorovi a zařízení. Účinnost takového programu souvisí s funkcívšechny parenchymy pacientů s cirhózou. Někteří autoři proto tvrdí, že screening by měl být vyloučen u pacientů s etiologií, která brání léčebné léčbě, nebo u pacientů s pokročilým onemocněním jater (třída C podle Child-Pugha).[Citace je zapotřebí ]
Po léčebných terapiích (chirurgická resekce, lokální ablativní terapie) se doporučuje pokračovat v ultrazvukovém screeningu nejdříve 1 měsíc, poté ve 3měsíčních intervalech po terapii, aby se posoudila účinnost terapie a detekovaly se další uzliny.[Citace je zapotřebí ]
Protinádorové terapie
Ultrazvukové vyšetření může být účinným postupem pro hodnocení odpovědi jaterních nádorů na léčbu. V průběhu let byla zvažována různá kritéria pro hodnocení účinnosti kurativní nebo paliativní terapie. Nyní bylo prokázáno, že stupeň nekrózy nádoru nekoreluje s průměrem nádoru, proto pro měření léčby nestačí jednoduché měření průměru nádoru (kritéria RECIST).[Citace je zapotřebí ]
V současné době je lokální odpověď na léčbu zaměřena na nekrózu nádorů diagnostikovanou kontrastními dynamickými zobrazovacími technikami a rozpoznávanou přítomností intratumorálních nezlepšených oblastí. Místní reakce na léčbu je definována jako:[Citace je zapotřebí ]A. úplná odpověď definovaná jako úplné vymizení všech známých lézí (nepřítomnost oblastí se zvýšeným nádorem, odrážející celkovou nekrózu nádoru) a absence dalších nových lézí, určená dvěma pozorováními s odstupem nejméně 4 týdnů; b. částečná odpověď, definovaná jako více než 50% snížení celkového zesílení nádoru u všech měřitelných lézí, stanoveno dvěma pozorováními s odstupem nejméně 4 týdnů. stabilní onemocnění (není popsáno v a, b nebo d) d. progresivní onemocnění, definované jako 25% zvětšení velikosti jedné nebo více měřitelných lézí nebo výskyt nových lézí.
Techniky hodnocení účinnosti terapie
Účinnost 2D ultrazvuku je nízká při hodnocení účinků terapie HCC nebo metastáz, protože není schopna odlišit životaschopnou nádorovou tkáň od postterapeutické nekrózy nádoru.[Citace je zapotřebí ]
Je však schopen detekovat výskyt nových lézí a posoudit výskyt jakýchkoli komplikací progrese onemocnění (ascites nebo trombóza portální žíly). Barevný dopplerovský ultrazvuk může být někdy užitečný, když dokáže ukázat přítomnost intratumorální vaskulatury jako známku neúplné léčby nebo intratumorálního opakování. Absence Dopplerova signálu nevylučuje přítomnost životaschopné nádorové tkáně. Průzkum CEUS, jehož schopnost zvýšit mikrocirkulaci uvnitř léze, prokázal svou užitečnost při monitorování terapeutické účinnosti. Jeho indikace jsou definovány pro ablační léčbu HCC (před, intra a po léčbě), zatímco monitorování systémových terapií HCC a metastáz není v tuto chvíli validovanými indikacemi, ale s prokázanou účinností v rozsáhlých klinických studiích (Claudon et al., 2008). Vyšetření CEUS nemůže zcela nahradit ostatní zobrazovací diagnostické metody, které se v současnosti používají, kvůli známým omezením metody ultrazvuku (závisí na operátorovi / zařízení, omezení ultrazvukového vyšetření). Kromě nadýmání dochází u pacientů s rakovinou k postterapeutické steatóze, která brání hluboké viditelnosti. Spirální CT sken zůstává metodou volby při monitorování léčby rakoviny, protože poskytuje přehled o prodloužení nádoru a není omezen nadýmáním nebo steatózou.[Citace je zapotřebí ]
Gadolinium MRI vyšetření je postup používaný stále častěji a jeho výhodou je absence ozáření a jeho vysoká citlivost při detekci vaskulatury nádorů, zejména u menších nádorů. However it remains an expensive and nota very accessible procedure, although it has a high specificity. Currently, CEUS and MRI areconsidered complementary methods to CT scan.[Citace je zapotřebí ]
Ultrasound monitoring ablative therapies (alcoholization – PEI, radiofrequency ablation – RFA)
Ablative therapies are considered curative treatments for HCC together with surgicalresection and liver transplantation and they are indicated for early tumor stages in patientswith good liver function. Also they aresuccessfully applied in the treatment of liver metastases, where surgical resection iscontraindicated. They are chemical (intratumoral ethanol injection) or thermal(radiofrequency, laser or microwave ablation). They are applied in order to obtain a fulltherapeutic response, without affecting liver function. Complete response is locally provedby complete tumor necrosis with a safety margin around the tumor.[Citace je zapotřebí ]
2D ultrasound, Doppler ultrasound and especially CEUS can play an important role in pretherapeuticstaging, particularly when sectional imaging investigations (CT, MRI) provideuncertain results or are contraindicated. During the interventional procedure, ultrasound allows guidance of the needle into the tumor. CEUS allows guidance in areas of viable tissueand avoids intratumoral necrotic areas. CEUS also allows assessment of therapeutic effectimmediately post-procedure (with the possibility of reintervention in case of partial response). To accurately assess the effectiveness of treatment it is mandatory tocompare the tumor diameter before therapy with the ablation area. The volume of damagedtissue must be higher than the initial tumor volume. CEUS appearance is that of central nonenhancedarea showing a peripheral homogeneous hyperenhanced rim due to post-procedureinflammation. 24 hours after the procedure the inflammatory peripheral rim is thinning andthe necrotic area appears larger than at the previous examination. Thus, a possible residualtumor may appear more evident. Residual tumor has poorly defined edges, irregular shape,and the tumor diameter is unchanged. Residual tumor tissue is evidenced at the periphery ofthe tumor as an eccentric area behaving as the original tumor at CEUS examination, witharterial hyperenhancement and portal and late wash-out. Ultrasound examination 24 hoursafter the procedure, including CEUS, can show apart from the character of the lesion anypotential post-intervention complications (e.g. active bleeding).[Citace je zapotřebí ]
In the first days after RFA both CEUS and spiral CT have low sensitivity in assessingtherapeutic efficacy. CT sensitivity 24 hours post-therapy is reported to be even lower thanCEUS. Difficulties in CEUS examination result from post-lesionhyperemia, presence of intratumoral air, ultrasound limitations (too deep lesion or thepresence of fatty liver) or lack of patient's cooperation (immediately after therapy). For thisreasons contrast imaging (CT or CEUS) control should be performed one month afterablation to confirm the result of the therapy.[Citace je zapotřebí ]
Local recurrence is defined as recurrence of a hyperenhanced area at tumor periphery in thearterial phase, with portal and late wash-out. Sometimes, especially for HCC treated byalcoholization (PEI) hyperenhanced septa or vessels can be shown inside the lesion.[Citace je zapotřebí ]
In case of successful treatment, US monitoring using CEUS is performed every threemonths. Although CE-CT and/or MRI are considered the method of choice in post-therapymonitoring, CEUS can be used in follow-up protocols, its diagnosticaccuracy being equivalent to that of CE-CT or MRI.[Citace je zapotřebí ]

Ultrasound monitoring of TACE therapy (transarterial chemoembolization)
Transarterial chemoembolization (TACE) is part of palliative therapies for HCC used inintermediate stages of the disease. It consists of selective angiographic catheterization of thehepatic artery and injection of chemotherapeutic agents (usually adriamycin, but othermolecules are currently the subject of clinical trials), followed by embolization of hepaticartery with gelfoam, alcohol or metal rings. A similar procedure istransarterial embolization but without chemotherapeutic agents injection, used in thetreatment of hypervascular liver metastases. These therapies are based on thepredominantly arterial vasculature of HCC and hypervascular metastases, while theremaining liver parenchyma has a dual vascular intake, predominantly portal. Their efficacyis high only for lesions who are hyperenhanced during arterial phase. The role of US islimited in the first few days after the procedure, and refers only to its complications, due toLipiodol retention mainly intratumoral, but also diffusely intrahepatic. On ultrasound,Lipiodol appears intensely hyperechoic inside the tumor, with significant posteriorattenuation which make US examination more difficult. On the other hand, CE-CT is alsolimited by the presence of Lipiodol (iodine oil), therefore the evaluation of therapeuticefficiency is currently made by indirect assessing Lipiodol binding to the tumor using nonenhancedCT. CE-MRI is not influenced by the presence of Lipiodol,but it is an expensive method and still difficult to reach. Several studies have proved similarefficacy, even superior, of CEUS compared to CE-CT and CE-MRI for the evaluation of postTACEtreatment results, while other studies have shown the limitations of CEUS especiallyfor deep or small lesions. Given the CEUS limitations, currently some authors consider CTas standard method for the evaluation of TACE and local ablative therapies and CEUS andCE-MRI as complementary methods. MonitoringTACE therapeutic results by contrast imaging techniques is performed as for ablativetherapies initially after one month then after every 3 months post-TACE.[Citace je zapotřebí ]
Given that TACE is indicated only for hyperenhanced lesions during arterial phase, CEUSplays a very important role in monitoring the dysplastic nodules to identify the momentwhen changes occur in arterial vasculature, being able to have an early therapeuticintervention in order to limit tumor progression, to increase patient survival, and thus tocreate a bridge to liver transplantation.[Citace je zapotřebí ]
Ultrasound monitoring of systemic therapies
Systemic therapies are procedures based on the affinity of certain molecules to inhibit eithertumor cell replication or multiplication of neoplastic vasculature (antiangiogenic therapies).[Citace je zapotřebí ]
They are intravenously administered and are indicated in advanced stages of liver tumordiseases, when there are no other effective therapeutic solutions. Among ultrasoundtechniques, CEUS is the one that brought a significant benefit not only by increasing thesensitivity and specificity of ultrasound in detecting liver metastases, but also by assessingthe efficacy of systemic therapy for HCC and metastases. The method has been adopted byoncologists since 2003 because it involves no irradiation and has no hepatic or renal toxicity,and it is now currently used in tumor therapeutic evaluation. It iscurrently used in large clinical trials aimed at determining the efficacy of different types ofanti-angiogenic molecules by quantifying intratumoral perfusion based on the statisticalanalysis performed using specific software during post-processing in order to assesstherapeutic efficacy as early as possible.[Citace je zapotřebí ]
Reference
- ^ Streba, Costin Teodor; Ionescu, Mihaela; Gheonea, Dan Ionut; Sandulescu, Larisa; Ciurea, Tudorel; Saftoiu, Adrian; Vere, Cristin Constantin; Rogoveanu, Ion (28 August 2012). "Contrast-enhanced ultrasonography parameters in neural network diagnosis of liver tumors". World Journal of Gastroenterology. 18 (32): 4427–4434. doi:10.3748/wjg.v18.i32.4427. ISSN 1007-9327. PMC 3436061. PMID 22969209.


