Tetrasulfid sodný - Sodium tetrasulfide - Wikipedia
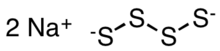 | |
| Jména | |
|---|---|
| Název IUPAC Tetrasulfid sodný | |
| Ostatní jména disodiumtetrasulfid, sulfid sodný | |
| Identifikátory | |
| Informační karta ECHA | 100.031.628 |
| Číslo ES |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| Vlastnosti | |
| Na2S4 | |
| Molární hmotnost | 174,24 g / mol |
| Vzhled | Tmavě červená, mírně viskózní kapalina nebo žlutý krystalický prášek |
| Hustota | 1,268 g / cm3 při 15,5 ° C |
| Bod tání | 275 ° C (527 ° F; 548 K) |
| Rozpustný ve vodě | |
| Nebezpečí | |
| Hlavní nebezpečí | Stabilní při pokojové teplotě, ale při zahřátí může být výbušný. Reakce s kyselinami nebo oxidačními činidly vytvoří plynné vedlejší produkty, které by byly při vdechování nebezpečné. |
| Bezpečnostní list | [1] [1] |
| NFPA 704 (ohnivý diamant) | |
| Nelze použít | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tetrasulfid sodný je anorganická sloučenina se vzorcem Na2S4. Je to žlutooranžová pevná látka, která se rozpustí hydrolýzou ve vodě.[2] Jsou předchůdci některých speciálních polymerů a meziproduktů v prototypech sodík-síra baterie.
Syntéza a struktura
Vyrábí se reakcí mezi elementární sírou a hydrogensulfidem sodným v alkoholickém roztoku:[3]
- 2NaSH + 4S → Na2S4 + H2S
Polysulfidové anionty přijímají klikaté řetězce atomů síry. Vzdálenosti S-S jsou asi 2,05 Å a úhly S-S-S-S jsou kolem 90 °.[4]
Reakce a aplikace
Po zpracování kyselinou se převede na sirovodík a elementární síra. Zpracováním alkylačními látkami se získají organické polysulfidy. V jedné komerční aplikaci se používá k výrobě síťování činidlo bis (triethoxysilylpropyl) tetrasulfid:[5]
- Na2S4 + 2 ClC3H6Si (OEt)3 → S.4[C3H6Si (OEt)3]2 + 2 NaCl
Někdy jako směs s jinými polysulfidy, tetrasulfid sodný se používá k výrobě polymeru zvaného thiokol. Reakce zahrnuje alkylaci s ethylenchlorid:
- Na2S4 + C.2H4Cl2 → 1 / n (C.2H4) SX]n + 2 NaCl
Tyto materiály, které mají přibližný vzorec (C2H4) SX]n (x ~ 4), jsou vysoce odolné vůči degradaci rozpouštědly a kyselinami.[6]
Reference
- ^ „Bezpečnostní list, tetrasulfid sodný“ (PDF). Pfaltz & Bauer.
- ^ Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 1. str. 365.
- ^ D. R. Brush (2000). "Sulfidy sodný". Kirk-Othmer Encyclopedia of Chemical Technology. Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002 / 0471238961.1915040902211908.a01. ISBN 0471238961.
- ^ R. Tegman „Krystalová struktura tetrasulfidu sodného, Na2S4„Acta Crystallogr. (1973). B29, 1463-1469 doi:10.1107 / S0567740873004735
- ^ Thurn, Friedrich; Meyer-Simon, Eugen; Michel, Rudolf "Verfahren zur Herstellung von Organosiliziumverbindungen (Kontinuální výroba bis [3- (triethoxysilyl) propyl] tetrasulfidu)" Ger. Offen. (1973), DE 2212239 AI 19731004.
- ^ Sulfidy, polysulfidy a sulfany “v Ullmann's Encyclopedia of Industrial Chemistry Ludwig Lange a Wolfgang Triebel, 2000, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a25_443

