Mapa kontaktů s proteiny - Protein contact map

A mapa kontaktů s proteiny představuje vzdálenost mezi všemi možnými aminokyselinový zbytek páry trojrozměrného proteinová struktura pomocí binárního dvojrozměrného matice. Pro dva zbytky a , prvek matice je 1, pokud jsou dva zbytky blíže než předem určená prahová hodnota, a 0 jinak. Byly navrženy různé definice kontaktů: Vzdálenost mezi Cα-Cα atom s prahovou hodnotou 6-12 A; vzdálenost mezi C.β-Cβ atomy s prahovou hodnotou 6-12 Å (C.α se používá pro Glycin ); a vzdálenost mezi postranním řetězcem centra hmoty.
Přehled
Kontaktní mapy poskytují více redukovanou reprezentaci proteinové struktury než její plné 3D atomové souřadnice. Výhodou je, že kontaktní mapy jsou neměnné vůči rotacím a překladům. Snadněji je předpovídají strojové učení metody. Rovněž se ukázalo, že za určitých okolností (např. Nízký obsah chybně předpovězených kontaktů) je možné rekonstruovat 3D souřadnice proteinu pomocí jeho kontaktní mapy.[1][2]
Kontaktní mapy se také používají pro bílkoviny superpozice a popsat podobnost mezi proteinovými strukturami.[3] Jsou předpovídány z proteinová sekvence nebo vypočítané z dané struktury.
Kontaktní předpověď mapy
S dostupností vysokého počtu genomových sekvencí je možné tyto sekvence analyzovat zbytky koevoluce. Účinnost tohoto přístupu vyplývá ze skutečnosti, že mutace v poloze i proteinu pravděpodobněji souvisí s mutací v poloze j než se zpětnou mutací i pokud jsou obě polohy funkčně spojeny (např. účastí se v enzymatické doméně nebo sousedením ve složeném proteinu nebo dokonce sousedením v oligomeru tohoto proteinu).[4]
Existuje několik statistických metod pro extrakci z a vícenásobné zarovnání sekvence takové spojené páry zbytků: pozorované versus očekávané frekvence párů zbytků (OMES);[5] substituční korelace McLachlan (McBASC);[6] statistická vazebná analýza; Vzájemné informace (MI) založené metody;[7] a nedávno analýza přímé vazby (DCA).[8][9]
Strojové učení Algoritmy dokázaly vylepšit metody analýzy MSA, zejména pro nehomologní proteiny (tj. mělké MSA).[10]
Předpovězené kontaktní mapy byly použity při predikci membránové proteiny kde jsou zaměřeny interakce helix-helix.[11]
HB Plot
Znalost vztahu mezi a protein Struktura a její dynamické chování je nezbytné pro pochopení funkce bílkovin. Popis trojrozměrné struktury proteinu jako sítě vodíkové vazby interakce (HB plot)[12] byl představen jako nástroj pro zkoumání struktury a funkce proteinů. Analýzou sítě terciárních interakcí lze zkoumat možné šíření informací v proteinu.
HB plot nabízí jednoduchý způsob analýzy proteinu sekundární struktura a terciární struktura. Vodíkové vazby stabilizující sekundární konstrukční prvky (sekundární vodíkové vazby) a ty, které vznikly mezi vzdálenými aminokyselina zbytky - definované jako terciární vodíkové vazby - lze snadno rozlišit na HB grafu, tedy aminokyselinové zbytky podílející se na stabilizaci proteinová struktura a funkce lze identifikovat.
Funkce
Děj rozlišuje mezi hlavním řetězcem - hlavním řetězcem, hlavním řetězcem -boční řetěz a boční řetěz na straně řetězu vodíkové vazby interakce. Rozvětvené vodíkové vazby a více vodíkových vazeb mezi nimi aminokyselina zbytky; a uvnitř a mezi řetězci Vodíkové vazby jsou také vyznačeny na grafech. Barevné třídy rozlišují tři třídy vodíkových vazeb; krátké (vzdálenost menší než 2,5 A mezi donorem a akceptorem), meziprodukt (mezi 2,5 Å a 3,2 Å) a dlouhé vodíkové vazby (větší než 3,2 Å).
Prvky sekundární struktury v grafu HB

V reprezentacích grafu HB jsou charakteristické vzory sekundární struktura prvky lze snadno rozpoznat následujícím způsobem:
- Helices lze identifikovat jako proužky přímo sousedící s úhlopříčkou.
- Antiparalelní beta listy se objeví v grafu HB jako příčná úhlopříčka.
- Paralelní beta listy se objeví v grafu HB jako rovnoběžná s úhlopříčkou.
- Smyčky se objeví jako přerušení úhlopříčky mezi příčnou úhlopříčkou beta-list motivy.
Příklady použití
Cytochrom P450s
The cytochrom P450s (P450s) jsou xenobiotikum -metabolizující membrána -vázaný heme -obsahující enzymy, které používají molekulární kyslík a elektrony z NADPH cytochrom P450 reduktáza oxidovat jejich substráty. CYP2B4, člen rodiny cytochromů P450 je jediným proteinem v této rodině, jehož Struktura rentgenového záření v otevřené i uzavřené formě 12 je zveřejněna. Srovnání otevřené a uzavřené struktury struktur CYP2B4 odhaluje rozsáhlé konformační přeskupení mezi dvěma stavy, s největší konformační změnou kolem zbytků 215-225, která je široce otevřená ve stavu bez ligandu a uzavřena po vazbě ligandu; a oblast kolem smyčky C poblíž hemu.

Zkoumání grafu HB uzavřeného a otevřeného stavu CYP2B4 odhalilo, že přeskupení terciárních vodíkových vazeb bylo ve vynikající shodě se současnými znalostmi cytochromu P450 katalytický cyklus.
První krok dovnitř P450 katalytický cyklus je identifikován jako vazba substrátu. Předběžné navázání ligandu poblíž vstupu rozbíjí vodíkové vazby S212-E474, S207-H172 v otevřené formě CYP2B4 a jsou vytvořeny vodíkové vazby E218-A102, Q215-L51, které fixují vstup v uzavřené formě, jak odhaluje obrázek HB .
Druhým krokem je přenos prvního elektronu z NADPH prostřednictvím řetězce přenosu elektronů. U elektronového přenosu dochází ke konformační změně, která spouští interakci P450 s NADPH cytochromem P450 reduktázou. Rozbití vodíkových vazeb mezi S128-N287, S128-T291, L124-N287 a vznik S96-R434, A116-R434, R125-I435, D82-R400 na NADPH cytochromu P450 reduktáze vazebné místo - jak je vidět na grafu HB - transformujte CYP2B4 do stavu konformace, kde dochází k navázání NADPH cytochromu P450 reduktázy.
Ve třetím kroku vstupuje kyslík do CYP2B4 v uzavřeném stavu - do stavu, kdy nově vytvořené vodíkové vazby S176-T300, H172-S304, N167-R308 otevírají tunel, který má přesně velikost a tvar kyslík molekula.
Rodina lipokalinů

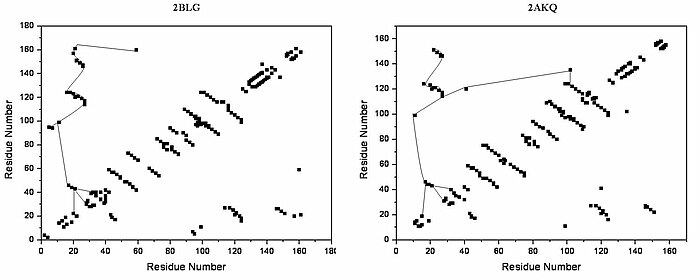
The lipokalin rodina je velká a různorodá rodina proteinů s tak malými funkcemi hydrofobní transportéry molekul. Beta-laktoglobulin je typickým členem rodiny lipokalinů. Bylo zjištěno, že beta-laktoglobulin má roli v transportu hydrofobních ligandů, jako je retinol nebo mastné kyseliny.[13] Své Krystalická struktura byly stanoveny [např. Qin, 1998] s různými ligandy a také ve formě bez ligandů. Dosud určené krystalické struktury ukazují, že typický lipokalin obsahuje osm pramenů antiparalelní - hlaveň uspořádaná tak, aby vytvořila kónickou centrální dutinu, ve které je vázán hydrofobní ligand. Struktura beta-laktoglobulinu ukazuje, že struktura ve tvaru sudu s centrální dutinou proteinu má „vstup“ obklopený pěti beta smyčky s centry kolem 26, 35, 63, 87 a 111, které procházejí konformační změnou během vazby ligandu a uzavírají dutinu.
Celkový tvar beta-laktoglobulinu je charakteristický pro rodinu lipokalinů.[Citace je zapotřebí ] V nepřítomnosti alfa-šroubovice, hlavní úhlopříčka téměř zmizí a příčné úhlopříčky představující beta-listy ovládnout děj. Relativně nízký počet terciárních vodíkových vazeb lze nalézt na grafu se třemi oblastmi s vysokou hustotou, z nichž jedna je připojena ke smyčce na zbytcích kolem 63, druhá je připojena ke smyčce kolem 87 a třetí oblast, která je spojen s oblastmi 26 a 35. Pátá smyčka kolem 111 představuje pouze jednu terciární vodíkovou vazbu v grafu HB.
V trojrozměrné struktuře se tvoří terciární vodíkové vazby (1) blízko vstupu, přímo zapojené do konformačního přeskupení během vazby ligandu; a (2) ve spodní části „sudu“. Pozemky HB otevřené a uzavřené formy beta-laktoglobulinu jsou velmi podobné, všechny jedinečné motivy lze rozpoznat v obou formách. Rozdíl v HB grafech otevřené formy a formy vázané na ligand ukazuje několik důležitých individuálních změn ve schématu terciární vodíkové vazby. Zejména tvorba vodíkových vazeb mezi Y20-E157 a S21-H161 v uzavřené formě může být rozhodující při konformačním přeskupení. Tyto vodíkové vazby leží na dně dutiny, což naznačuje, že uzavření vstupu lipokalinu začíná, když ligand dosáhl dna dutiny a rozbil vodíkové vazby R123-Y99, R123-T18 a V41-Q120. Je známo, že lipokaliny mají velmi nízkou sekvenční podobnost s vysokou strukturní podobností.[Citace je zapotřebí ] Jediné konzervované regiony jsou přesně regiony kolem 20 a 160 s neznámou rolí.
Viz také
- Ramachandran spiknutí
- Strukturní klasifikace proteinů
- KOCOUR
- HB plot
- Tečkovaný graf (bioinformatika)
- Matice sebepodobnosti
Reference
- ^ Pietal, MJ .; Bujnicki, JM .; Kozlowski, LP. (Červen 2015). „GDFuzz3D: metoda rekonstrukce proteinové 3D struktury z kontaktních map, založená na neeuklidovské funkci vzdálenosti“. Bioinformatika. 31 (21): 3499–505. doi:10.1093 / bioinformatika / btv390. PMID 26130575.
- ^ Vassura M, Margara L, Di Lena P, Medri F, Fariselli P, Casadio R (2008). "Rekonstrukce 3D struktur z kontaktních map proteinů". Transakce IEEE / ACM na výpočetní biologii a bioinformatiku. 5 (3): 357–367. doi:10.1109 / TCBB.2008.27. PMID 18670040. S2CID 6080543.
- ^ Holm L, Sander C (srpen 1996). "Mapování proteinového vesmíru". Věda. 273 (5275): 595–603. Bibcode:1996Sci ... 273..595H. doi:10.1126 / science.273.5275.595. PMID 8662544. S2CID 7509134.
- ^ Fitch, W. M .; Markowitz, E. (1970). "Vylepšená metoda pro stanovení variability kodonů v genu a její aplikace na rychlost fixace mutací v evoluci". Biochem. Genet. 4 (5): 579–593. doi:10.1007 / bf00486096. PMID 5489762. S2CID 26638948.
- ^ Kass, I .; Horovitz, A. (2002). "Mapování drah alosterické komunikace v GroEL analýzou korelovaných mutací". Proteiny. 48 (4): 611–617. doi:10.1002 / prot.10180. PMID 12211028. S2CID 40289209.
- ^ Gobel, U .; et al. (1994). "Korelované mutace a zbytkové kontakty v proteinech". Proteiny. 18 (4): 309–317. doi:10,1002 / prot. 340180402. PMID 8208723. S2CID 14978727.
- ^ Wollenberg, K. R .; Atchley, W. R. (2000). "Oddělení fylogenetických a funkčních asociací v biologických sekvencích pomocí parametrického bootstrapu". Proc. Natl. Acad. Sci. USA. 97 (7): 3288–3291. Bibcode:2000PNAS ... 97,3288 W.. doi:10.1073 / pnas.97.7.3288. PMC 16231. PMID 10725404.
- ^ Weigt, M; Bílá, RA; Szurmant, H; Hoch, JA; Hwa, T (2009). "Identifikace přímých zbytkových kontaktů v interakci protein - protein předáním zprávy". Proc Natl Acad Sci USA. 106 (1): 67–72. arXiv:0901.1248. Bibcode:2009PNAS..106 ... 67W. doi:10.1073 / pnas.0805923106. PMC 2629192. PMID 19116270.
- ^ Morcos, F; et al. (2011). „Analýza přímé vazby koevoluce zbytků zachycuje nativní kontakty napříč mnoha rodinami proteinů“. Proc Natl Acad Sci USA. 108 (49): E1293 – E1301. doi:10.1073 / pnas.1111471108. PMC 3241805. PMID 22106262.
- ^ Hanson, Jack; Paliwal, Kuldip K; Litfin, Thomas; Yang, Yuedong; Zhou, Yaoqi (2018). „Přesná předpověď map kontaktů bílkovin spojením zbytkové dvourozměrné obousměrné dlouhé krátkodobé paměti s konvolučními neuronovými sítěmi“. Bioinformatika. 34 (23): 4039–4045. doi:10.1093 / bioinformatika / bty481. PMID 29931279. S2CID 49335891.
- ^ Lo A, Chiu YY, Rødland EA, Lyu PC, Sung TY, Hsu WL (2009). „Predikce interakcí helix-helix ze zbytkových kontaktů v membránových proteinech“. Bioinformatika. 25 (8): 996–1003. doi:10.1093 / bioinformatika / btp114. PMC 2666818. PMID 19244388.
- ^ Bikadi Z, Demko L, Hazai E (2007). "Funkční a strukturní charakterizace proteinu na základě analýzy jeho sítě vodíkových vazeb pomocí grafu vodíkových vazeb". Arch Biochem Biophys. 461 (2): 225–234. doi:10.1016 / j.abb.2007.02.020. PMID 17391641.
- ^ Pérez, M. D .; Calvo, M (1995). „Interakce beta-laktoglobulinu s retinolem a mastnými kyselinami a jeho role jako možné biologické funkce tohoto proteinu: přehled“. Journal of Dairy Science. 78 (5): 978–88. doi:10.3168 / jds.S0022-0302 (95) 76713-3. PMID 7622732.
externí odkazy
- DESTILOVAT - predikce strukturních rysů proteinů (včetně kontaktních map proteinových zbytků)
- Nástroje strukturní proteomiky - zahrnuje kontaktní mapy aminokyselin
- ProfCon - predikce kontaktů mezi zbytky
- TMHcon - predikce kontaktů helix-helix konkrétně v transmembránových částech membránových proteinů
- TMhit - Nová metoda predikce interakce transmembránová spirála-spirála založená na kontaktech zbytků[mrtvý odkaz ]
- CMAPpro - Server predikce mapy proteinových kontaktů
- CMPyMOL —Nástroj pro vizualizaci mapování proteinových kontaktů v PyMOL[mrtvý odkaz ]



