Polyamorfóza - Polyamorphism - Wikipedia

Polyamorfóza je schopnost látky existovat v několika různých amorfní modifikace. Je to analogické s polymorfismus z krystalický materiály. Mnoho amorfních látek může existovat s různými amorfními vlastnostmi (např. Polymery). Polyamorfismus však vyžaduje dva odlišné amorfní stavy s jasným, diskontinuálním (prvního řádu) fázový přechod mezi nimi. Pokud k takovému přechodu dojde mezi dvěma stabilními kapalnými skupinami, lze polyamorfní přechod označovat také jako a přechod kapalina-kapalina.[3]
Přehled
I když amorfní materiály nemají číslo dlouhý dosah periodické atomové uspořádání, stále existuje významná a rozmanitá lokální struktura na meziatomových délkových stupnicích (viz struktura kapalin a sklenic ). Různé místní struktury mohou produkovat amorfní fáze stejného chemického složení s různými fyzikálními vlastnostmi, jako je např hustota. V několika případech byly pozorovány ostré přechody mezi dvěma různě hustými amorfními stavy stejného materiálu. Amorfní led je jeden důležitý příklad (viz také příklady níže).[4] Očekává se, že několik z těchto přechodů (včetně vody) skončí za sekundu kritický bod.
Přechody kapalina – kapalina
Polyamorfismus může platit pro všechny amorfní stavy, tj. Sklenice, jiné amorfní pevné látky, podchlazené kapaliny, běžné kapaliny nebo kapaliny. Přechod kapalina-kapalina je však přechod, který se vyskytuje pouze v kapalném stavu (červená čára ve fázovém diagramu vpravo nahoře). V tomto článku jsou přechody kapalina-kapalina definovány jako přechody mezi dvěma kapalinami stejné chemické látky. Pojem přechod kapalina-kapalina může kdekoli označovat také běžnější přechody mezi kapalnými směsmi různého chemického složení.
Stabilní kapalný stav je na rozdíl od většiny skel a amorfních pevných látek termodynamicky stabilní rovnovážný stav. Nové přechody kapalina-kapalina nebo kapalina-kapalina ve stabilním kapalném (nebo kapalném) stavu jsou tedy snadněji analyzovány než přechody v amorfních pevných látkách, kde jsou argumenty komplikovány nerovnovážnou, neergodickou povahou amorfního stavu.
Rapoportova teorie
Přechody kapalina-kapalina byly původně zvažovány Rapoportem v roce 1967 za účelem vysvětlení maxima křivky tání vysokého tlaku u některých kapalných kovů.[5] Rapoportova teorie vyžaduje existenci maxima křivky tání v polyamorfních systémech.
Zdvojnásobte potenciály
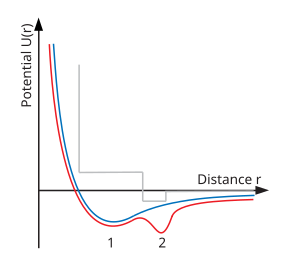
Jedním fyzickým vysvětlením polyamorfózy je existence potenciálu dvojité atomové dvojice jamek (viz diagram vpravo dole). Je dobře známo, že běžný kritický bod kapalina-plyn se objeví, když potenciál meziatomového páru obsahuje minimum. Při nižších energiích (teplotách) částice zachycené v tomto minimu kondenzují do kapalného stavu. Při vyšších teplotách však tyto částice mohou ze studny uniknout a ostrá definice kapaliny a plynu se ztrácí. Molekulární modelování ukázal, že přidání druhé jamky vytvoří další přechod mezi dvěma různými kapalinami (nebo tekutinami) s druhým kritickým bodem.[2]
Příklady polyamorfózy
Polyamorfóza byla experimentálně pozorována nebo teoreticky navržena v křemík, kapalný fosfor, trifenylfosfát, mannitol a v některých dalších molekulární síť -formující látky.[6]
Voda a strukturní analogy
Nejznámějším případem polyamorfózy je amorfní led. Natlakování konvenčních hexagonálních ledových krystalů na asi 1,6 GPa při tekutý dusík teplota (77 K) je převádí na amorfní led s vysokou hustotou. Po uvolnění tlaku je tato fáze stabilní a má hustotu 1,17 g / cm3 při 77 K a 1 baru. Následné zahřátí na 127 K při okolním tlaku transformuje tuto fázi na amorfní led s nízkou hustotou (0,94 g / cm3 při 1 baru).[7] Pokud se však amorfní led s vysokou hustotou zahřeje na 165 K ne při nízkých tlacích, ale při zachování komprese 1,6 GPa a poté se ochladí zpět na 77 K, vytvoří se další amorfní led, který má ještě vyšší hustotu 1,25 g / cm3 při 1 baru. Všechny tyto amorfní formy mají velmi různá spektra vibračních mřížek a mezimolekulární vzdálenosti.[8][9] Podobný náhlá kapalina-amorfní fázový přechod je předpovídán v kapalném křemíku při chlazení za vysokých tlaků[10] Toto pozorování je založeno na počítačových simulacích molekulární dynamiky prvních principů a lze jej očekávat intuitivně, protože je známo, že čtyřboký amorfní uhlík, křemík a germanium jsou strukturně analogické s vodou.[11]
Oxidové kapaliny a sklenice
Yttria -oxid hlinitý taje jsou dalším systémem, o kterém se uvádí, že vykazuje polyamorfózu. Bylo pozorováno pozorování fázového přechodu kapalina-kapalina v podchlazené kapalině.[12] Ačkoli toto je v literatuře sporné.[13] Polyamorfismus byl také hlášen u brýlí Yttria-Alumina. Tavenina Yttria-Alumina zhášená od přibližně 1900 ° C rychlostí ~ 400 ° C / s může vytvářet sklenice obsahující druhou současně existující fázi. To se děje pro určité poměry Y / Al (asi 20–40 mol% Y2Ó3). Obě fáze mají stejné průměrné složení, ale různou hustotu, molekulární strukturu a tvrdost.[14] Diskutuje se však také o tom, zda je druhá fáze skelná nebo krystalická.[15]Po ochlazení byly pozorovány kontinuální změny hustoty oxid křemičitý nebo oxid germaničitý. Ačkoli kontinuální změny hustoty nepředstavují přechod prvního řádu, mohou svědčit o základním náhlém přechodu.
Organické materiály
Polyamorfismus byl také pozorován u organických sloučenin, jako jsou kapaliny trifenylfosfit při teplotách mezi 210 K a 226 K [16][17][18][19] a n-butanol při teplotách mezi 120 K a 140 K.[20][21]
Polyamorfóza je také důležitou oblastí ve farmaceutické vědě. Amorfní forma léčiva má obvykle mnohem lepší rozpustnost ve vodě (ve srovnání s analogickou krystalickou formou), ale skutečná lokální struktura v amorfním léčivu se může lišit v závislosti na metodě použité k vytvoření amorfní fáze. Mannitol je první farmaceutická látka představovat polyamorfismus.[22] Kromě běžné amorfní fáze lze při teplotě a tlaku místnosti připravit i druhou amorfní fázi. Tato nová fáze má podstatně nižší energii, nižší hustotu a vyšší teplotu skelného přechodu. Jelikož je mannitol široce používán ve farmaceutických formulacích tablet, nabízí polyamorfismus mannitolu mocný nástroj pro konstrukci vlastností a chování tablet. [23]
Viz také
Reference
- ^ Mishima, O .; Mishima, Osamu (1998). "Vztah mezi kapalinou, podchlazenou a sklovitou vodou". Příroda. 396 (6709): 329. Bibcode:1998 Natur.396..329M. doi:10.1038/24540. S2CID 4328846.
- ^ A b Franzese, G .; Malescio, G; Skibinsky, A; Buldyrev, SV; et al. (2001). "Obecný mechanismus pro generování fázového přechodu kapalina-kapalina". Příroda. 409 (6821): 692–5. arXiv:cond-mat / 0102029. Bibcode:2001 Natur.409..692F. doi:10.1038/35055514. PMID 11217853. S2CID 4419993.
- ^ Hancock, BC; Shalaev, EY; Shamblin, SL (2002). „Polyamorfismus: perspektiva farmaceutické vědy“. The Journal of Pharmacy and Pharmacology. 54 (8): 1151–2. doi:10.1211/002235702320266343. PMID 12195833. S2CID 20047984.
- ^ Mishima, O .; Calvert, L. D .; Whalley, E. (1985). "Zjevně přechod 1. řádu mezi dvěma amorfními fázemi ledu vyvolaný tlakem". Příroda. 314 (6006): 76. Bibcode:1985 Natur.314 ... 76M. doi:10.1038 / 314076a0. S2CID 4241205.
- ^ Rapoport, E. (1967). "Model pro maxima křivky tání při vysokém tlaku". J. Chem. Phys. 46 (2891): 2891–2895. Bibcode:1967JChPh..46.2891R. doi:10.1063/1.1841150.
- ^ „Anomální vlastnosti vody“. Citováno 30. srpna 2015.
- ^ Schober, H; Koza, M .; Tölle, A .; Fujara, F .; et al. (1997). „Amorfní polymorfismus v ledu vyšetřován nepružným rozptylem neutronů“. Physica B: Kondenzovaná látka. 241–243: 897–902. Bibcode:1997PhyB..241..897S. doi:10.1016 / S0921-4526 (97) 00749-7.
- ^ Loerting, Thomas; Salzmann, Christoph; Kohl, Ingrid; Mayer, Erwin; et al. (2001). „Druhý výrazný strukturální„ stav “amorfního ledu s vysokou hustotou při 77 K a 1 baru“. Fyzikální chemie Chemická fyzika. 3 (24): 5355. Bibcode:2001PCCP .... 3,5355L. doi:10.1039 / b108676f. S2CID 59485355.
- ^ K. J. Rao (2002). Strukturní chemie brýlí. Elsevier. p. 120. ISBN 978-0-08-043958-7.
- ^ Morishita, T. (2004). „Amorfní forma s vysokou hustotou a polyamorfní transformace křemíku“. Phys. Rev. Lett. 93 (55503): 55503. Bibcode:2004PhRvL..93e5503M. doi:10.1103 / PhysRevLett.93.055503. PMID 15323706.
- ^ Benmore, C. J .; Hart, R .; Mei, Q .; Cena, D .; et al. (2004). "Chemické řazení v amorfní a kapalné vodě, Si a Ge". Phys. Rev. B. 72 (132201): 132201. Bibcode:2005PhRvB..72m2201B. doi:10.1103 / PhysRevB.72.132201.
- ^ Greaves, G; Wilding, MC; Fearn, S; Langstaff, D; Kargl, F; Cox, S; Van, QV; Majérus, O; et al. (2008). „Detekce přechodů kapaliny / kapalné fáze prvního řádu v taveninách oxid yttritý-oxid hlinitý“ (PDF). Věda. 322 (5901): 566–70. Bibcode:2008Sci ... 322..566G. doi:10.1126 / science.1160766. PMID 18948535. S2CID 10368768.
- ^ Barnes, AC; Skinner, LB; Losos, PS; Bytchkov, A; et al. (2009). "Kapalné / kapalné fázové přechody v Yttria-Alumina" (PDF). Dopisy o fyzické kontrole. 103 (22): 225702. Bibcode:2009PhRvL.103v5702B. doi:10.1103 / PhysRevLett.103.225702. PMID 20366109.
- ^ Aasland, S .; McMillan, P. F. (1994). „Hustota řízená separace kapalina-kapalina v systému AI2O3 – Y2O3“. Příroda. 369 (6482): 633. Bibcode:1994 Natur.369..633A. doi:10.1038 / 369633a0. S2CID 4325330.
- ^ Skinner, LB; Barnes, AC; Losos, PS; Crichton, WA (2008). "Fázová separace, krystalizace a polyamorfóza v systému Y2O3-Al2O3". J. Phys .: Condens. Hmota. 20 (20): 205103. Bibcode:2008JPCM ... 20t5103S. doi:10.1088/0953-8984/20/20/205103. PMID 21694284.
- ^ Kurita, R. (2004-10-29). "Kritické jevy spojené s přechodem kapalina-kapalina v molekulární kapalině". Věda. 306 (5697): 845–848. Bibcode:2004Sci ... 306..845K. doi:10.1126 / science.1103073. ISSN 0036-8075. PMID 15514150. S2CID 29634533.
- ^ Ha, Alice; Cohen, Itai; Zhao, Xiaolin; Lee, Michelle; et al. (1996). „Podchlazené kapaliny a polyamorfóza †“. The Journal of Physical Chemistry. 100: 1–4. doi:10.1021 / jp9530820.
- ^ Poole, P. H. (1997). "Polymorfní fázové přechody v kapalinách a brýlích". Věda. 275 (5298): 322–323. doi:10.1126 / science.275.5298.322. S2CID 95734427.
- ^ Paolo M. Ossi (2006). Neuspořádané materiály: úvod. Springer. p. 65. ISBN 978-3-540-29609-6.
- ^ Kurita, Rei; Tanaka, Hajime (2005-07-13). „O hojnosti a obecné povaze přechodu fáze kapalina-kapalina v molekulárních systémech“. Journal of Physics: Condensed Matter. 17 (27): L293 – L302. doi:10.1088 / 0953-8984 / 17/27 / L01. ISSN 0953-8984.
- ^ Syme, Christopher D .; Mosses, Joanna; González-Jiménez, Mario; Šebanova, Olga; Walton, Finlay; Wynne, Klaas (2017). „Frustrace krystalizace fází kapalných krystalů“. Vědecké zprávy. 7 (1): 42439. Bibcode:2017NatSR ... 742439S. doi:10.1038 / srep42439. ISSN 2045-2322. PMC 5314399. PMID 28209972.
- ^ Zhu, muži; Wang, Jun-Qiang; Perepezko, John H .; Yu, Lian (2015). "Možná existence dvou amorfních fází d-mannitolu souvisejících s přechodem prvního řádu". The Journal of Chemical Physics. 142 (24): 244504. Bibcode:2015JChPh.142x4504Z. doi:10.1063/1.4922543. ISSN 0021-9606. PMID 26133438.
- ^ Zhu, muži; Yu, Lian (2017). „Polyamorfóza D-mannitolu“. The Journal of Chemical Physics. 146 (24): 244503. Bibcode:2017JChPh.146x4503Z. doi:10.1063/1.4989961. ISSN 0021-9606. PMID 28668061.
