Perfluorotributylamin - Perfluorotributylamine - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC 1,1,2,2,3,3,4,4,4-nonafluor-N,N-bis (1,1,2,2,3,3,4,4,4-nonafluorbutyl) butan-1-amin | |
| Preferovaný název IUPAC 1,1,2,2,3,3,4,4,4-nonafluor-N,N-bis (nonafluorbutyl) butan-1-amin | |
| Ostatní jména Fluorinert | |
| Identifikátory | |
3D model (JSmol ) | |
| Zkratky | PFTBA |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.005.659 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C12F27N | |
| Molární hmotnost | 671.096 g · mol−1 |
| Hustota | 1,884 g / ml |
| Bod tání | -50 ° C (-58 ° F; 223 K) |
| Bod varu | 178 ° C (352 ° F; 451 K) |
| Nerozpustný | |
| Rozpustnost v methanolu a isopropylalkohol | Nerozpustný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
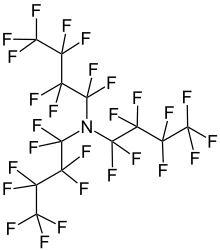
Perfluorotributylamin (PFTBA), označovaný také jako FC43, je bezbarvá kapalina vzorce N (C4F9)3. Sloučenina se skládá ze tří butyl skupiny připojené k amin centrum, ve kterém byly všechny atomy vodíku nahrazeny fluor. Tato sloučenina se vyrábí pro elektronický průmysl spolu s dalšími perfluoralkylaminy. Vysoký stupeň fluorace významně snižuje bazicitu centrálního aminu v důsledku účinků přitahujících elektrony.[1]
Příprava
Připravuje se elektrofluorací tributylamin použitím fluorovodík jako rozpouštědlo a zdroj fluoru:[2]
- N (C.4H9)3 + 27 HF → N (C.4F9)3 + 27 hodin2
Použití
Sloučenina má dvě komerční použití. Používá se jako přísada do Fluosol, umělá krev. Tato aplikace využívá vysokou rozpustnost kyslíku a oxidu uhličitého v rozpouštědle, jakož i nízkou viskozitu a toxicitu.[3] Je také součástí Fluorinert chladicí kapaliny. CPU některých počítačů jsou ponořeny do této kapaliny, aby se usnadnilo chlazení.[2]
Výklenek
Sloučenina se používá jako kalibrační látka[4] v plynová chromatografie když analytická technika používá hmotnostní spektrometrie jako detektor k identifikaci a kvantifikaci chemických sloučenin v plynech nebo kapalinách. Při ionizaci v hmotnostním spektrometru se sloučenina rozkládá v opakovatelném vzoru za vzniku fragmentů specifických hmot, které lze použít k vyladění hmotnostní odezvy a přesnosti hmotnostního spektrometru. Nejčastěji používané ionty jsou ty, které mají přibližnou hmotnost 69, 131, 219, 414 a 502 atomové hmotnostní jednotky.
Bezpečnost
Fluorofluidy mají obecně velmi nízkou toxicitu, a to natolik, že byly hodnoceny jako syntetická krev.[2]
Zásah do životního prostředí
Je to skleníkový plyn s oteplovacími vlastnostmi více než 7 000krát vyššími než u oxid uhličitý po dobu 100 let,[5][6] a jako takový je nejsilnějším skleníkovým plynem, jaký kdy byl objeven.[7] Jeho koncentrace v atmosféře je přibližně 0,18 dílu na bilion. Sloučenina může v atmosféře přetrvávat až 500 let. Hexafluorid síry, nicméně, má GWP 23 900,[8] díky čemuž bude mnohem silnější.

Potenciál globálního oteplování skleníkových plynů a PFTBA
Viz také
Reference
- ^ „Vyladění základnosti | Cambridge MedChem Consulting“. www.cambridgemedchemconsulting.com. Citováno 2020-08-11.
- ^ A b C Michael G. Costello, Richard M. Flynn, John G. Owens (2001). „Fluoroethers and Fluoroamines“. Kirk-Othmer Encyclopedia of Chemical Technology. Weinstein: Wiley-VCH. doi:10.1002 / 0471238961.0612211506122514.a01.pub2. ISBN 978-0471238966.CS1 maint: používá parametr autoři (odkaz)
- ^ Garrelts, J. C. (1990). „Fluosol: Tekutina dodávající kyslík pro použití v perkutánní transluminální koronární angioplastice“. DICP: The Annals of Pharmacotherapy. 24 (11): 1105–1112. PMID 2275237.
- ^ Dunnivant, Frank a Ginsbach, Jake. „PLYNOVÁ CHROMATOGRAFIE, KAPALNÁ CHROMATOGRAFIE, KAPILÁRNÍ elektroforéza - HROMADNÁ SPEKTROMETRIE ZÁKLADNÍ ÚVOD“, kapitola 7, ISBN 978-0-9882761-0-9, [1]., Listopad 2012.
- ^ Hong, A. C .; Young, C. J .; Hurley, M. D .; Wallington, T. J .; Mabury, S.A. (2013). „Perfluorotributylamin: nový skleníkový plyn s dlouhým poločasem rozpadu“. Dopisy o geofyzikálním výzkumu. 40 (22): 6010–6015. Bibcode:2013GeoRL..40.6010H. doi:10.1002 / 2013GL058010.
- ^ Goldenberg, Suzanne (10. prosince 2013). „Nově objevený skleníkový plyn je 7 000krát silnější než CO2'". Opatrovník. Citováno 11. prosince 2013.
- ^ Goldenberg, Suzanne (11. prosince 2013). „Nově objevený skleníkový plyn“ 7 000krát silnější než CO2"". Matka Jonesová. Citováno 12. prosince 2013.
- ^ „2.10.2 Přímé potenciály globálního oteplování“. Mezivládní panel o změně klimatu. 2007. Citováno 22. února 2013.

