Nogalamycin - Nogalamycin
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.162.283 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C39H49NE16 | |
| Molární hmotnost | 787,80 g / mol |
| Nebezpečí | |
| Hlavní nebezpečí | kardiotoxický |
| Související sloučeniny | |
Související sloučeniny | menogaril |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Nogalamycin je antracyklin antibiotikum produkované půdou bakterie Streptomyces nogalater. Má protinádorové vlastnosti, ale je také vysoce kardiotoxický. Méně kardiotoxický polosyntetický analog menogaril byl vyvinut v 70. letech. V současné době se nogalamycin a menogaril nepoužívají klinicky.[1]
Biosyntéza
Biosyntéza antracyklinů zahrnuje konstrukci aglykónového jádra (a polyketid syntáza typu II ), ke kterému je připojen jeden nebo více zbytků cukru. Nogalamycin se skládá ze tří složek:

- nogalamycinon (černý), aglykonové jádro
- nogalose (purpurová)
- nogalamin (zelený)
Každá složka je vytvořena samostatně a poté ligována dohromady dvěma glykosyltransferázami.[2] Všechna zařízení spojená s biosyntézou nogalamycinu jsou umístěna ve stejném biosyntetickém genovém klastru S. nogalater.
Biosyntéza nogalamycinonu

Biosyntetická cesta k aglykonovému jádru nogalamycinu byla stanovena kombinací bioinformatické analýzy a klonování jednotlivých složek biosyntetické dráhy.[3][4][5] Biosyntetická cesta je podobná jako u aklavinonu (aglykonové jádro většiny antracyklinů, včetně doxorubicin ), jediný rozdíl je v tom, že první acylová skupina, která je zavedena do PKS, je spíše acetát než propionát. Následující geny se podílejí na biosyntéze hlavních druhů nogalamycinonu:[3][6]
- snoa1 (ketosyntáza-α)
- snoa2 (faktor délky řetězce ketosyntázy-β)
- snoa3 (acylový nosičový protein)
- snoaD (ketoreduktáza)
- snoaE (aromatáza)
- snoaM (cykláza)
- snoaB (oxygenáza)
- snoaC (methyltransferáza)
- snoaL (cykláza)
- snoaF (ketoreduktáza)
Biosyntéza nogalaminu a nogalosy
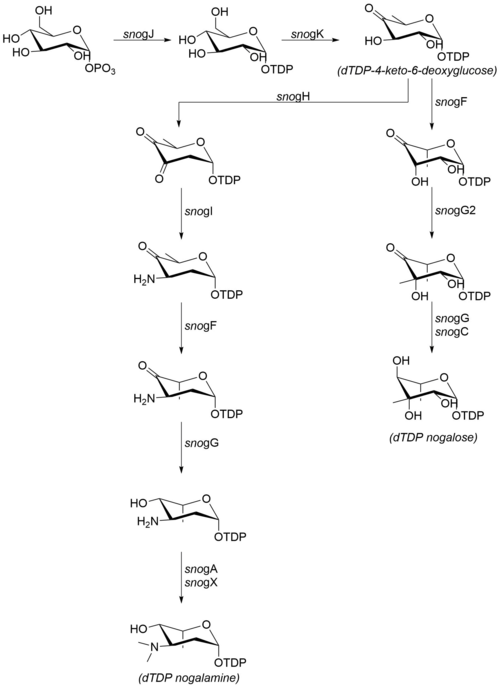
Cukrové skupiny, které jsou připojeny k nogalamycinonu, se vyrábějí z glukóza-1-fosfát. Ačkoli kroky následující po dTDP-4-keto-6-deoxyglukóze nebyly potvrzeny in vitro, vysoký stupeň sekvenční podobnosti s homologními enzymy z jiných organismů naznačuje, že mechanismus probíhá tak, jak je podrobně uvedeno vpravo.[7] Následující enzymy se podílejí na biosyntéze nogalaminu a nogalosy:[6]
- snogJ (dTDP-glukóza syntáza)
- snogK (4,6-dehydratáza)
- snogF (3,5-epimeráza)
- snogH (2,3-dehydratáza)
- snogN (neznámé)
- snogI (aminotransferáza)
- snogG (ketoreduktáza)
- snogC (ketoreduktáza)
- snogA (N-methyltransferáza)
- snogX (N-methyltransferáza)
- snogG2 (C-methyltransferáza)
Všimněte si, že zatímco velká část literatury odkazuje na konečnou, permethylovanou sacharidovou část jako „nogalose“,[8] novější údaje naznačují, že nogalozová část na nogalamycinu je methylována poté, co bylo jádro nogalamycinonu glykosylováno.[2]
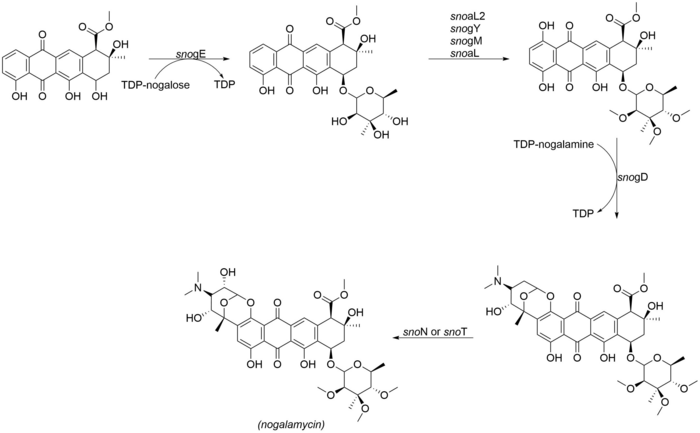
Nogalamycinonová glykosylace a přizpůsobení
Nejpozoruhodnějším aspektem struktury nogalamycinu je dvojí připojení nogalaminu skrz Ó-glykosylace a také vazbou uhlík-uhlík v poloze C2 jádra nogalamycinonu,[2] Následující enzymy se účastní závěrečných kroků přizpůsobení nogalamycinu. SnoN a snoT jsou geny v genu klastru nogalamycinu, které pravděpodobně katalyzují konečnou hydroxylaci:
- snogE (glykosyltransferáza)
- snoaL2 (hydroxyláza)
- snogY (O-methyltransferáza)
- snogM (domnělá O-methyltransferáza)
- snogL (domnělá O-methyltransferáza)
- snogD (glykosyltransferáza)
- snoN / T.
Reference
- ^ NOGALAMYCIN. ChemicalBook.com. Zpřístupněno 28. listopadu 2012.
- ^ A b C Siitonen, V. a kol. Identifikace kroků pozdní fáze glykosylace v biosyntetické dráze antracyklinového nogalamycinu. ChemBioChem 13, 120–128 (2011).
- ^ A b Torkkell, S. a kol. Celý nogalamycinový biosyntetický genový shluk Streptomyces nogalater: charakterizace oblasti DNA o velikosti 20 kb a tvorba hybridních struktur. Mol Gen Genomics 266, 276–288 (2001).
- ^ Räty, K. a kol. Klonování a charakterizace klastru Streptomyces galilaeus aclacinomycins polyketid syntáza (PKS). Gene 293, 115–122 (2002).
- ^ Metsä-Ketelä, M., Palmu, K., Kunnari, T., Ylihonko, K. & Mäntsälä, P. Engineering Anthracycline Biosynthesis towards Angucyclines. Antimicrob. Agenti Chemother. 47, 1291-1296 (2003).
- ^ A b Sultana, A. Mechanistické pohledy na biosyntézu polyketidových antibiotik. (2006).
- ^ K. Kharel, M., Lian, H. & Rohr, J. Charakterizace biosyntetické dráhy TDP-d-ravidosaminu: enzymatická syntéza TDP-d-ravidosaminu z thymidin-5-fosfátu a glukóza-1-fosfátu v jedné nádobě . Organic & Biomolecular Chemistry 9, 1799–1808 (2011).
- ^ Duchamp, D. J., Wiley, P. F., Hsiung, V. & Chidester, C. G. Struktura, absolutní konfigurace a chemie nogalosy. J. Org. Chem. 36, 2670–2673 (1971).
| Tento antiinfekční lék článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
