Pravidla Green – Davies – Mingos - Green–Davies–Mingos rules
v organokovová chemie, Pravidla Green – Davies – Mingos předpovědět regiochemie pro nukleofilní adice na 18 elektronů kovové komplexy obsahující více nenasycených ligandy.[1] Pravidla byla zveřejněna v roce 1978 organokovovými chemiky Stephen G. Davies, Malcolm Green, a Michael Mingos. Popisují, jak a kde jsou nenasycené uhlovodíky obecně náchylnější nukleofilní útok po komplexaci.[1]
Pravidlo 1
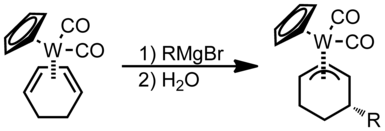
Nukleofilní útok je preferován u sudých polyenů (sudý haptičnost ).[1]

Pravidlo 2
Nukleofily přednostně přidávají k acyklickým polyenům spíše než k cyklickým polyenům.[1]

Pravidlo 3
Nukleofily přednostně přidávají k sudé haptičnosti polyenové ligandy na konci.[1]Nukleofily přidávají k liché haptičnosti acyklické polyenové ligandy v terminální poloze, pokud je kov vysoce elektrofilní, jinak se přidávají na interním místě.
Zjednodušené: ještě předtím liché a otevřené před uzavřením
Následuje diagram ukazující trendy reaktivity sudé / liché haptičnosti a otevřených / uzavřených π-ligandů.
Kovové centrum odebírá elektrony. Tento účinek je zesílen, pokud je kov také připojen k karbonylu. Kovy chudé na elektrony se špatně navazují na karbonylovou skupinu. Čím více kovu odebírá elektron, tím má ligand CO trojný vazebný charakter. To dává ligandu vyšší silovou konstantu. Výsledná silová konstanta nalezená pro ligovaný karbonyl představuje stejnou silovou konstantu pro π ligandy, pokud nahradily ligand CO ve stejném komplexu.
Nukleofilní adice nenastane, pokud kCO * (efektivní silová konstanta pro ligand CO) je pod prahovou hodnotou [2]
Následující obrázek ukazuje ligovaný kov navázaný na karbonylovou skupinu. Tato skupina má částečný kladný náboj, a proto je náchylná k nukleofilnímu útoku. Pokud je ligand představovaný Ln byly π-ligandem, aktivoval by se také k nukleofilnímu útoku.
Příchozí nukleofilní útok se odehrává na jednom z konců π-systému na obrázku níže:
V tomto příkladu lze kruhový systém považovat za analogický s 1,3-butadienem. Podle pravidel Green – Davies – Mingos, protože butadien je otevřeným π-ligandem dokonce haptičnosti, dojde k nukleofilnímu útoku v jedné z koncových poloh π-systému. K tomu dochází, protože LUMO butadienu má na koncích spíše větší laloky než vnitřní polohy.
Příklady komplexů
Následuje příklad komplexu obsahujícího tři typy π-ligandů, demonstrující preferenční útok nukleofilu na jeden ze π-systémů.

Výše uvedený komplex obsahuje tři typy π-ligandů. Cyklooktanový kruh obsahuje butadienový fragment vlevo a allylový fragment vpravo. Cyklopentadienový ligand na středu kobaltu poskytuje třetí typ.
K útoku na kyanidový nukleofil dochází přednostně na konci butadienového fragmentu. (Výše uvedený obrázek ukazuje nesprávný produkt)
Podle výše uvedených pravidel je butadienový fragment otevřený ligand sudé hapticity, který má větší reaktivitu než allylový fragment, otevřený ligand liché hapticity nebo cyklopentadien, uzavřený ligand liché hapticity.
K útoku dochází na konci, což bude mít za následek zobrazení konjugovaného produktu.
Interní útok
Zde ligand, který je již připojen k kovu, působí jako nukleofil a interně útočí na centrum kovu.[3][4]

Účinky typů ligandů na regiochemii útoku
Nukleofilní útok na terminální pozici allyl ligandy, když π přijímající ligand je přítomen.[5]
Pokud jsou přítomny ligandy darující sigma, pumpují elektrony do ligandu a dochází k útoku ve vnitřní poloze.

Účinky asymetrických ligandů
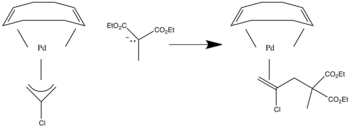
Jsou-li přítomny asymetrické allylové ligandy, dochází k útoku na substituovanější pozici.[6]

V tomto případě dojde k útoku na uhlík s oběma R skupinami připojenými k němu, protože to je substituovanější poloha.
Účinky velkých π ligandů
Když velké π ligandy [7] jsou přítomni, mohou podstoupit různé druhy nukleofilních útoků. Na následujícím obrázku může dojít k nukleofilnímu útoku buď shora, nebo zdola, čímž se sníží dvojná vazba a přidá se nukleofil.

Tento nukleofilní útok může nastat buď nahoře nebo dole a přidat nukleofil.
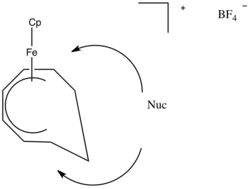
Využití při syntéze
Při syntéze lze použít nukleofilní adici k n ligandům. Jedním z příkladů je výroba cyklických sloučenin kovů.[8] Nukleofily se přidávají do středu ligandu π a produkují metallobutan.


Reference
- ^ A b C d E Davies, Stepehn G.; Zelená, Malcolm L. H.; Mingos, D. Michael P. (1978). „Nukleofilní přidání do organotranszičních kovových kationtů obsahujících nenasycené uhlovodíkové ligandy: průzkum a interpretace“. Čtyřstěn. 34 (20): 3047–3077. doi:10.1016 / 0040-4020 (78) 87001-X.
- ^ Bush Russell C .; Angelici Robert J. (1986). „Kovový karbonyl νCO silové konstanty jako prediktory reaktivity komplexu π-ethylenu a π-benzenu s nukleofily “. Journal of the American Chemical Society. 108 (10): 2735–2742. doi:10.1021 / ja00270a037.
- ^ Periana Roy A .; Bergman Robert G. (1984). "Rychlé intramolekulární přeskupení hydrido (cyklopropyl) rhodiového komplexu na rhodacyklobutan. Nezávislá syntéza metalocyklu přidáním hydridu k centrálnímu atomu uhlíku kationtového rhodia π-allylového komplexu." Journal of the American Chemical Society. 106 (23): 7272–7273. doi:10.1021 / ja00335a084.
- ^ Suzuki, Tomohiro; Okada, Goro; Hioki, Yasunori; Fujimoto, Hiroshi (2003). „Teoretické studium reaktivity komplexů (π-Allyl) molybdenu“. Organometallics. 22 (18): 3649–3658. doi:10.1021 / om0207459.
- ^ Aranyos, Attila; Szabó, Kálmán J .; Castaño, Ana M .; Bäckvall, Jan-E. (1997). „Centrální versus terminální útok v nukleofilním přidání komplexů (π-allyl) palladia. Účinky a mechanismus ligandu“. Organometallics. 16 (5): 1058–1064. doi:10,1021 / om960950m.
- ^ Delbecq, F .; Lapouge, C. (2000). "Regioselektivita nukleofilního přídavku k (η3-allyl) Palladiové komplexy. Teoretická studie “. Organometallics. 19 (14): 2716–2723. doi:10.1021 / om0003032.
- ^ Schörshusen, Sonja; Heck, Jürgen (2007). „Transformace cyklooktatetraenu zprostředkovaná kovy na nové methylenové můstky, cyklické sloučeniny“. Organometallics. 26 (22): 5386–5394. doi:10.1021 / om700539e.
- ^ Periana, Roy A (1986). "Aktivace uhlík-uhlík organických sloučenin s malým kruhem uspořádáním komplexů cykloalkylhydridorhodia na rhodacykloalkany. Syntéza metallacyklobutanů, včetně těch s terciární vazbou kov-uhlík, nukleofilní adicí na π-allylové komplexy." Journal of the American Chemical Society. 108 (23): 7346–7355. doi:10.1021 / ja00283a033.