Flagellin - Flagellin
| Flagellin | |||||||
|---|---|---|---|---|---|---|---|
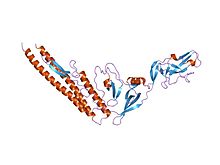 Homologní Salmonella flagellin, zobrazující spirálové jádro D0 / D1 a také rozšíření D3 (PDB 1io1). | |||||||
| Identifikátory | |||||||
| Organismus | |||||||
| Symbol | FliC | ||||||
| UniProt | P04949 | ||||||
| |||||||
| Flagellin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | Flagellin | ||||||||
| Pfam | PF00700 | ||||||||
| InterPro | IPR001492 | ||||||||
| SCOP2 | 1ucu / Rozsah / SUPFAM | ||||||||
| |||||||||
Flagellin je kulová koule protein který se uspořádá v dutém válci a vytvoří vlákno v a bakteriální bičík. Má hmotnost asi 30 000 až 60 000 daltony. Bičík je hlavní složkou bakteriálního bičíku a je přítomen ve velkém množství na téměř všech bičíkatých bakteriích.
Struktura
Struktura bičíku je odpovědná za spirálovitý tvar bičíkového vlákna, který je důležitý pro jeho správnou funkci.[1] Přenáší se středem vlákna ke špičce, kde spontánně polymeruje do části vlákna. Rozvíjí se FliS (P26608) bičíkový sekreční chaperon během přepravy.[2] Vlákno je tvořeno jedenácti menšími „protofilamenty“, z nichž devět obsahuje bičík ve tvaru L a další dva ve tvaru R.[3]
Spirálovitý N- a C-konce flagellinu tvoří vnitřní jádro proteinu flagellinu a je zodpovědný za jeho schopnost polymerovat do vlákna. Střední zbytky tvoří vnější povrch bičíkového vlákna. Zatímco konce proteinu jsou si velmi podobné u všech bakteriálních bičíků, střední část je velmi variabilní a u některých druhů může chybět. Flagelinové domény jsou očíslovány od spirálovitého jádra (D0 / D1) směrem ven (D2, ...); při pohledu z aminokyselinové sekvence se na obou koncích objeví D0 / D1. Bičíkovité strukturní proteiny se nacházejí v jiných částech bičíku, jako je háček (flgE; P75937), tyč na základně a víčko nahoře.[4]
Prostřední částE-coli (a související) flagellin, D3, zobrazuje a beta-folium složit a zdá se, že udržuje bičíkovou stabilitu.[5]
Imunitní odpověď
U savců
Savci často mají získané imunitní odpovědi (T-buňka a protilátka odpovědi)[6] na bičíkovité bakterie, které se často vyskytují na bičíkových antigenech. Bylo také prokázáno, že Flagellin přímo interaguje s TLR5 na T buňkách.[7] Některé bakterie jsou schopné přepínat mezi více bičíky geny abychom se této reakci vyhnuli.
Sklon imunitní odpovědi na bičík lze vysvětlit dvěma fakty:
- Flagellin je extrémně hojný protein v bičíkatých bakteriích.
- Existuje specifický vrozený imunitní receptor který rozpoznává bičík, Mýtný receptor 5 (TLR5 ).[8]
V rostlinách
Kromě toho je známo, že 22-aminokyselinová sekvence (flg22) konzervované N-koncové části flagellinu aktivuje obranné mechanismy rostlin.[9] Flagellinovo vnímání v Arabidopsis thaliana funguje prostřednictvím receptoru podobné kinázy FLS2 (FLAGELLIN SENSING 2).[10] Po detekci flg22 se FLS2 rychle váže na BAK1 (kináza 1 asociovaná s BRI1), aby zahájila signalizaci reciproční transfosforylací jejich kinázových domén.[11] Mitogenem aktivované proteinové kinázy (MAPK) působí jako následné signální sloučeniny, což vede nakonec k imunitě spouštěné PAMP, ve které je více než 900 genů regulováno nahoru / dolů po léčbě flg22.
Preimulace pomocí syntetického flg22-peptidu vedla ke zvýšené odolnosti proti bakteriálním útočníkům.
Reference
- ^ Steiner TS (únor 2007). „Jak flagellin a mýtný receptor 5 přispívají k enterické infekci“. Infekce a imunita. 75 (2): 545–52. doi:10.1128 / IAI.01506-06. PMC 1828527. PMID 17118981.
- ^ Vonderviszt F, Namba K (2013). Struktura, funkce a sestavení bičíkových axiálních proteinů. Austin, TX: Bioscience Database Madame Curie.
- ^ Maki-Yonekura S, Yonekura K, Namba K (duben 2010). "Konformační změna bičíku pro polymorfní převinutí bičíkového vlákna". Přírodní strukturní a molekulární biologie. 17 (4): 417–22. doi:10.1038 / nsmb.1774. PMID 20228803.
- ^ Imada K (duben 2018). "Bakteriální bičíková axiální struktura a její konstrukce". Biofyzikální recenze. 10 (2): 559–570. doi:10.1007 / s12551-017-0378-z. PMC 5899737. PMID 29235079.
- ^ Samatey FA, Imada K, Nagashima S, Vonderviszt F, Kumasaka T, Yamamoto M, Namba K (březen 2001). "Struktura bakteriálního bičíkového protofilamentu a důsledky pro přepínač pro supercoiling". Příroda. 410 (6826): 331–7. Bibcode:2001 Natur.410..331S. doi:10.1038/35066504. PMID 11268201.
- ^ Genta RM (leden 1997). „Imunobiologie gastritidy Helicobacter pylori“. Semináře o gastrointestinálních onemocněních. 8 (1): 2–11. PMID 9000497.
- ^ Sharma N, Akhade AS, Qadri A (duben 2013). „Sfingosin-1-fosfát potlačuje sekreci CXCL8 vyvolanou TLR z lidských T buněk“. Journal of Leukocyte Biology. 93 (4): 521–8. doi:10.1189 / jlb.0712328. PMID 23345392.
- ^ Kathrani A, Holder A, Catchpole B, Alvarez L, Simpson K, Werling D, Allenspach K (2012). „Haplotyp TLR5 spojený s rizikem psího zánětlivého onemocnění střev dává hyperreaktivitu bičíku“. PLOS ONE. 7 (1): e30117. Bibcode:2012PLoSO ... 730117K. doi:10.1371 / journal.pone.0030117. PMC 3261174. PMID 22279566.
- ^ García AV, Hirt H (01.01.2014). "Salmonella enterica indukuje a rozvrací imunitní systém rostlin". Hranice v mikrobiologii. 5: 141. doi:10.3389 / fmicb.2014.00141. PMC 3983520. PMID 24772109.
- ^ Gómez-Gómez L, Boller T (červen 2000). „FLS2: kináza podobná receptoru LRR zapojená do vnímání bakteriálního elicitorního bičíku u Arabidopsis“. Molekulární buňka. 5 (6): 1003–11. doi:10.1016 / S1097-2765 (00) 80265-8. PMID 10911994.
- ^ Chinchilla D, Zipfel C, Robatzek S, Kemmerling B, Nürnberger T, Jones JD, Felix G, Boller T (červenec 2007). „Komplex receptoru FLS2 a BAK1 indukovaný bičíkem iniciuje obranu rostlin“. Příroda. 448 (7152): 497–500. Bibcode:2007 Natur.448..497C. doi:10.1038 / nature05999. hdl:11858 / 00-001M-0000-0012-3840-F. PMID 17625569.
externí odkazy
- Flagellin v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Odolnost vůči bakteriálním bičíkům a chorobám rostlin, publikoval Zipfel. et al. (2004) Abstraktní článek
