Dikobalt edetát - Dicobalt edetate
 | |
 | |
| Jména | |
|---|---|
| Ostatní jména Kelocyanor | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.048.227 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C10H12Spol2N2Ó8.6H2Ó | |
| Molární hmotnost | 406,08 g / mol 514,18 g / mol (hexahydrát) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Dikobalt edetát je koordinační sloučenina s přibližným vzorcem Co2(EDTA ) (H2Ó)6. Je to derivát (nepřirozené) aminokyseliny ethylendiamintetraacetát.
Roztoky této pevné látky byly v Evropě použity jako protijed otrava kyanidem, s obchodním názvem Kelocyanor.[1] Samotný dikobaltalt je však sám o sobě toxický, zvláště pokud v krvi není dostatek kyanidu, aby s ním reagoval, takže je vhodný pouze pro závažné případy otravy. V minulosti se pracovištím ve Velké Británii, která se zabývají kyanidem, doporučovalo ponechat si „soupravu Kelocyanor“, která by měla být převezena do nemocnice spolu s pacientem, ale tato praxe byla přerušena, protože by mohla lékaře uvést v omyl, aby antidotum zbytečně používali.[2]
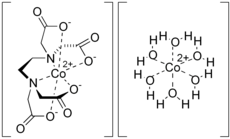
Struktura
Sloučenina je polymerní v krystalické formě. Polovina Co2+ ionty jsou vázány na EDTA2− a další Co.2+ ionty jsou vázány na čtyři vodní ligandy stejně jako karboxylát ligandy na [Co (EDTA)]2− subjekt.[3] Ve vodném roztoku dochází k depolymeraci za vzniku [Co (EDTA)]2− a [Co (H2Ó)6]2+ ionty, z nichž každý je kineticky labilní a má vysokou afinitu ke kyanidu.
Související sloučeniny
Oxidace [Co (II) (EDTA)]2− dává [Co (III) (EDTA)]−, který je tak kineticky inertní, že jej lze opticky vyřešit.[4]
Reference
- ^ Pickering WG (prosinec 1985). „Kyanidová toxicita a rizika dikobaltitetátu“. Br Med J (Clin Res Ed). 291 (6509): 1644. doi:10.1136 / bmj.291.6509.1644-a. PMC 1418389. PMID 2866807.
- ^ „Otrava kyanidem - nová doporučení pro léčbu první pomoci“. Výkonný ředitel pro zdraví a bezpečnost. Archivováno z původního dne 20. října 2009.
- ^ E. F. K. Mccandlish, T. K. Michael; Rose, N.J .; Neal, J. A .; Lingafelter, E. C .; Rose, N.J. (1978). „Srovnání struktur a vodných roztoků [(O-Fenylenediaminetetraacetato (2 -)] kobaltu (II) a [Ethylenediaminetetraacetato (2 -)] Cobaltu (II)“. Inorg. Chem. 17 (6): 1383–94. doi:10.1021 / ic50184a001.
- ^ Dwyer, F. P .; Garvan, F.L. (1960). „Rozlišení iontu ethylendiamintetracetatocobaltátu (III)“. Inorg. Synth. VI: 192–4. doi:10.1002 / 9780470132371.ch61. ISBN 978-0-470-13237-1.
