Carboryne - Carboryne
v organoboronová chemie, a carboryne je nestabilní derivát orto-karboran se vzorcem B10C2H10.[1] Nazývají se také 1,2-dehydro-o-karborany. Atomy vodíku na jednotce C2 v mateřské Ó-karboran chybí. Sloučenina se podobá a je isolobal s benzyně.[2][3][4] Karborynová sloučenina byla poprvé vytvořena v roce 1990 počínaje o-karboranem. Atomy vodíku připojené k uhlíku jsou odstraněny pomocí n-butyllithium v tetrahydrofuran a výsledné lithium dianion reaguje s bróm při 0 ° C za vzniku bromoaniontu.
Zahřátím reakční směsi na 35 ° C se uvolní carboryne, který se může následně zachytit vhodným dienes:
jako anthracen (dovolit si triptycen molekula) a furan v 10 až 25% chemický výtěžek.
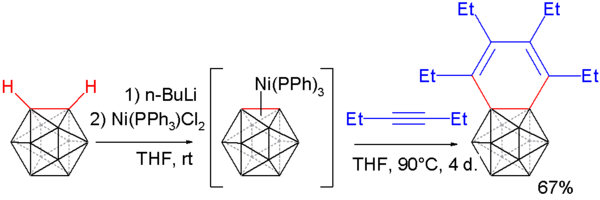
Carborynes reaguje s alkyny na benzokarborany [5][6] v úpravě výše popsaného postupu. O-karboran je deprotonován n-butyllithium jako dříve a poté reagoval s dichlor-di (trifenylfosfino) niklem na niklem koordinovaný karboryn. Tato sloučenina reaguje s 3-hexynem v alkynová trimerace k benzokarboranu.
Monokrystal Rentgenová difrakce analýza této sloučeniny ukazuje značné délka vazby alterace v benzenovém kruhu (164,8 odpoledne do 133,8 hod.) vyloučeno aromatičnost.
Viz také
Reference
- ^ Zhao, Da; Xie, Zuowei (2016). "Nedávný pokrok v chemii carborynes". Recenze koordinační chemie. 314: 14–33. doi:10.1016 / j.ccr.2015.07.011.
- ^ Gingrich, H.L .; Ghosh, T .; Huang, Q .; Jones, M. (1990). „1,2-Dehydro-o-karboran“. Journal of the American Chemical Society. 112 (10): 4082–4083. doi:10.1021 / ja00166a080.
- ^ Jemmis, E. D .; Kiran, B. (1997). "Struktura a lepení v B10X2H10 (X = C a Si). Perverzní povrch 1,2-dehydro-o-disilaboranu “. Journal of the American Chemical Society. 119 (19): 4076–4077. doi:10.1021 / ja964385q.
- ^ Kiran, B .; Anoop, A .; Jemmis, E. D. (2002). "Kontrola stability prostřednictvím překrytí shody: closo-karborany a closo-silaborany". Journal of the American Chemical Society. 124 (16): 4402–4407. doi:10.1021 / ja016843n.
- ^ Deng, L .; Chan, H.-S .; Xie, Z. (2006). „Nikl zprostředkovaný regioselektivní [2 + 2 + 2] cykloadice Carboryne s Alkyny“. Journal of the American Chemical Society. 128 (24): 7728–7729. doi:10.1021 / ja061605j. PMID 16771473.
- ^ Jemmis, E. D .; Anoop, A. (2004). „Teoretické studium reakcí inzerce komplexů Benzyn- a Carboryne-Ni“ (PDF). Maui High Performance Computing Center Application Briefs. Air Force Maui Optical & Supercomputing Site (AMOS). 2004: 51. Archivovány od originál (pdf) dne 13. 7. 2006.