Atomový faktor balení - Atomic packing factor
v krystalografie, atomový těsnicí faktor (APF), účinnost balenínebo frakce balení je zlomek objemu v Krystalická struktura který je obsazen složenými částicemi. Je to bezrozměrné množství a vždy méně než jednota. v atomový systémy, podle konvence, APF se určuje za předpokladu, že atomy jsou tuhé koule. Za poloměr koulí se považuje maximální hodnota, aby se atomy nepřekrývaly. U jednosložkových krystalů (těch, které obsahují pouze jeden typ částic) je obalová frakce matematicky znázorněna
kde Nčástice je počet částic v jednotkové buňce, PROTIčástice je objem každé částice a PROTIjednotková buňka je objem obsazený jednotkovou buňkou. Matematicky lze dokázat, že u jednosložkových struktur má nejhustší uspořádání atomů APF asi 0,74 (viz Keplerova domněnka ), získaný uzavřené struktury. U vícesložkových struktur (například s intersticiálními slitinami) může APF překročit 0,74.
Faktor atomového balení jednotkové buňky je relevantní pro studium věda o materiálech, kde vysvětluje mnoho vlastností materiálů. Například, kovy s vysokým atomovým těsnicím faktorem bude mít vyšší "zpracovatelnost" (tvárnost nebo kujnost ), podobně jako je cesta hladší, když jsou kameny blíže k sobě, což umožňuje atomům kovů snadněji klouzat kolem sebe.
Jednokomponentní krystalové struktury
Běžný koule balení přijaté atomovými systémy jsou uvedeny níže s odpovídajícím podílem na obalu.
- Šestihranný těsně zabalený (HCP): 0,74[1]
- Tvář centrovaný kubický (FCC): 0,74[1] (také nazývaný kubický uzavřený, CCP)
- Krychle zaměřená na tělo (BCC): 0,68[1]
- Jednoduché kubické: 0.52[1]
- Diamantový krychlový: 0.34
Většina kovů má strukturu HCP, FCC nebo BCC.[2]

Jednoduché kubické
Pro jednoduché kubické balení je počet atomů na jednotku buňky jeden. Strana jednotkové buňky má délku 2r, kde r je poloměr atomu.
Tvář centrovaný kubický

Pro kubickou jednotkovou buňku se středem tváře je počet atomů čtyři. Z horního rohu krychle lze nakreslit čáru diagonálně do dolního rohu na stejné straně krychle, což se rovná 4r. Pomocí geometrie a délky strany A může souviset s r jako:
Znát toto a vzorec pro objem koule, je možné vypočítat APF následujícím způsobem:
Krychle zaměřená na tělo

The primitivní jednotková buňka pro centrovaný na tělo krystalová struktura obsahuje několik frakcí převzatých z devíti atomů (jsou-li částice v krystalu atomy): jedna v každém rohu krychle a jeden atom ve středu. Protože objem každého z osmi rohových atomů je sdílen mezi osmi sousedními buňkami, obsahuje každá buňka BCC ekvivalentní objem dvou atomů (jeden centrální a jeden v rohu).
Každý rohový atom se dotýká středového atomu. Přímka, která je nakreslena z jednoho rohu krychle středem a do druhého rohu, prochází 4r, kde r je poloměr atomu. Geometrií je délka úhlopříčky A√3. Proto lze délku každé strany struktury BCC vztahovat k poloměru atomu o
Znát toto a vzorec pro objem koule, je možné vypočítat APF následujícím způsobem:
Šestihranný těsně zabalený
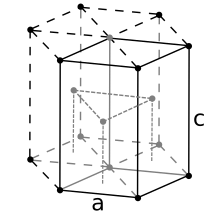
Pro šestihranný uzavřený struktura derivace je podobná. Zde je jednotkovou buňkou (ekvivalent 3 primitivních jednotkových buněk) šestihranný hranol obsahující šest atomů (pokud jsou částice v krystalu atomy). Ve skutečnosti jsou tři atomy ve střední vrstvě (uvnitř hranolu); navíc pro horní a dolní vrstvu (na základnách hranolu) je centrální atom sdílen se sousední buňkou a každý ze šesti atomů na vrcholech je sdílen s dalšími pěti sousedními buňkami. Celkový počet atomů v buňce je tedy 3 + (1/2) × 2 + (1/6) × 6 × 2 = 6. Každý atom se dotýká dalších dvanácti atomů. Tak teď být délka strany základny hranolu a být jeho výška. Druhá je dvojnásobná vzdálenost mezi sousedními vrstvami, i. E., dvojnásobek výšky pravidelného čtyřstěnu, jehož vrcholy zaujímá (řekněme) centrální atom spodní vrstvy, dva sousední necentrální atomy stejné vrstvy a jeden atom střední vrstvy „spočívající“ na předchozích třech. Je zřejmé, že hrana tohoto čtyřstěnu je . Li , pak lze snadno vypočítat jeho výšku , a proto, . Ukázalo se tedy, že objem jednotkové buňky hcp je (3/2)√3 , to je 24√2 .
Potom je možné vypočítat APF následujícím způsobem:
Viz také
Reference
- ^ A b C d Ellis, Arthur B .; et al. (1995). Teaching General Chemistry: A Materials Science Companion (3. vyd.). Washington, DC: Americká chemická společnost. ISBN 084122725X.
- ^ Moore, Lesley E .; Inteligentní, Elaine A. (2005). Chemie pevných látek: Úvod (3. vyd.). Boca Raton, Florida: Taylor & Francis, CRC. str. 8. ISBN 0748775161.
Další čtení
- Schaffer; Saxena; Antolovich; Brusky; Warner (1999). Věda a design strojírenských materiálů (2. vyd.). New York, NY: WCB / McGraw-Hill. 81–88. ISBN 978-0256247664.
- Callister, W. (2002). Věda o materiálech a inženýrství (6. vydání). San Francisco, Kalifornie: John Wiley and Sons. str.105–114. ISBN 978-0471135760.


![{ displaystyle { begin {aligned} mathrm {APF} & = { frac {N _ { mathrm {atom}} V _ { mathrm {atom}}} {V _ { text {jednotková buňka}}}} = { frac {1 cdot { frac {4} {3}} pi r ^ {3}} { levý (2r pravý) ^ {3}}} [10 bodů] & = { frac { pi} {6}} přibližně 0,5236 end {zarovnáno}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a66938286dbb653970c990206dcd99f945ccc268)

![{ displaystyle { begin {aligned} mathrm {APF} & = { frac {N _ { mathrm {atom}} V _ { mathrm {atom}}} {V _ { text {jednotková buňka}}}} = { frac {4 cdot { frac {4} {3}} pi r ^ {3}} { vlevo ({2 { sqrt {2}} r} vpravo) ^ {3}}} [10pt] & = { frac { pi { sqrt {2}}} {6}} přibližně 0,740 , 48048 . End {zarovnáno}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f98537d25607c30458b1027c44f6f66aa81c834c)

![{ displaystyle { begin {aligned} mathrm {APF} & = { frac {N _ { mathrm {atom}} V _ { mathrm {atom}}} {V _ { text {jednotková buňka}}}} = { frac {2 cdot { frac {4} {3}} pi r ^ {3}} { vlevo ({ frac {4r} { sqrt {3}}} vpravo) ^ {3} }} [10pt] & = { frac { pi { sqrt {3}}} {8}} přibližně 0,680 , 174 , 762 ,. End {zarovnáno}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b16a2740493531217460ed8aba6c7bc5c3750505)







![{ displaystyle { begin {aligned} mathrm {APF} & = { frac {N _ { mathrm {atom}} V _ { mathrm {atom}}} {V _ { text {jednotková buňka}}}} = { frac {6 cdot { frac {4} {3}} pi r ^ {3}} {{ frac {3 { sqrt {3}}} {2}} a ^ {2} c} } [10pt] & = { frac {6 cdot { frac {4} {3}} pi r ^ {3}} {{ frac {3 { sqrt {3}}} {2} } (2r) ^ {2} { sqrt { frac {2} {3}}} cdot 4r}} = { frac {6 cdot { frac {4} {3}} pi r ^ { 3}} {{ frac {3 { sqrt {3}}} {2}} { sqrt { frac {2} {3}}} cdot 16r ^ {3}}} [10 bodů] & = { frac { pi} { sqrt {18}}} = { frac { pi} {3 { sqrt {2}}}} přibližně 0,740 , 480 , 48 ,. end { zarovnaný}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a215654e5c3e0ff24af09fc03af14c06f5607314)