Anti-periplanar - Anti-periplanar - Wikipedia
Anti-periplanar je termín používaný v organické chemii k popisu úhlu vazby A – B – C – D v molekule. V tomto přizpůsobovači je vzepětí úhel vazby A – B a vazby C – D je větší než + 150 ° nebo menší než -150 °[1] (Obrázky 1 a 2 ). Anti-periplanar se v učebnicích často používá jako přísně anti-koplanární,[2] s diheedrickým úhlem A-B C-D 180 ° (obrázek 3). V Newmanova projekce, bude molekula ve střídavém uspořádání s antipiperiplanárními funkčními skupinami směřujícími nahoru a dolů, 180 ° od sebe (viz obrázek 4). Obrázek 5 ukazuje 2-chlor-2,3-dimethylbutan v projekci pilového koně s chlórem a vodíkovým antipiperiplanarem navzájem.
Syn-periplanar je podobný anti-periplanar. V syn-periplanárním konformátoru jsou A a D na stejné straně roviny vazby, s úhlem vzepětí A – B a C – D mezi + 30 ° a –30 ° (viz obrázek 2).
 Obrázek 1: Funkční skupiny A a D jsou anti-periplanární | 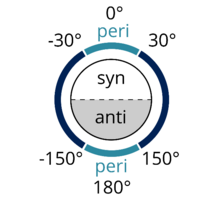 Obrázek 2: Funkční skupiny jsou považovány za periplanární, pokud mají úhel vzepětí menší než −150 ° nebo větší než + 150 ° nebo −30 ° až + 30 °. Převzato z postavy Dreamtheatra zveřejněné na Wikimedia Commons.[3] |  Obrázek 3: Znázornění přísně antikoplanární konformace. A, B, C a D jsou ve stejné rovině a úhel vzepětí mezi A – B a C – D je 180 °. |  Obrázek 4: Newmanova projekce ukazující A a D anti-periplanar. | 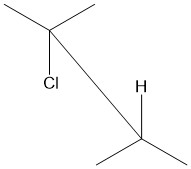 Obrázek 5: Sawhorseova projekce 2-chlor-2,3-diemthylbutanu ukazující Cl a H anti-periplanar. |
Molekulární orbitaly
Důležitým faktorem antiperiplanárního konformeru je interakce mezi molekulárními orbitaly. Anti-periplanární geometrie umístí spojovací orbitál a anti-spojovací orbitál přibližně paralelně k sobě nebo syn-periplanárně. Obrázek 6 je další znázornění 2-chlor-2,3-dimethylbutanu (obrázek 5), ukazující orbitál vázající se na CH, σC – H, a C – Cl anti-bonding orbital, σ *C – Cl, syn-periplanar. Paralelní orbitály se mohou překrývat a zapojit se do nich hyperkonjugace. Pokud je vazebný orbitál donorem elektronů a protivazebným orbitálem je akceptor elektronů, pak vazebný orbitál bude schopen darovat elektronegativitu do protivazebného orbitálu. Tato interakce donor-akceptor plněný-nevyplněný má celkový stabilizační účinek na molekulu. Dárcovství ze spojovacího orbitalu do anti-bondingového orbitalu však také povede k oslabení obou těchto vazeb. Na obrázku 6 je 2-chlor-2,3-dimethylbutan stabilizován hyperkonjugací z elektronového daru z σC-H do σ *C-Cl, ale vazby C – H i C – Cl jsou oslabené. Molekulární orbitální diagram ukazuje, že míchání σC – H a σ *C – Cl ve 2-chlor-2,3-dimethylbutanu snižuje energii obou orbitalů (obrázek 7).
 Obrázek 6: Orbitál s vazbou C – H je zarovnaný s orbitálem proti vazbě C – Cl a může darovat do orbitalu proti vazbě prostřednictvím hyperkonjugace. |  Obrázek 7: Energie orbitálu vázajícího se na C – H a na orbitálu spojujícího C – Cl nižší, když se smíchají. |
Příklady anti-periplanární geometrie v mechanismech
E2 mechanismus
A bimolekulární eliminační reakce nastane v molekule, kde rozbíjející se vazba uhlík-vodík a odstupující skupina jsou antipiperiplanar[4][5][6][7] (Postavení 8). Tato geometrie je upřednostňována, protože zarovnává σC-H a σ *C-X orbitaly.[8][9] Obrázek 9 ukazuje σC-H orbitální a σ *C-X oběžná dráha je vzájemně rovnoběžná a umožňuje σC-H orbitální darovat do σ *C-X anti-bonding orbital prostřednictvím hyperkonjugace. To slouží k oslabení vazby C-H a C-X, přičemž obě jsou přerušeny v E.2 reakce. Také nastavuje molekulu, aby snáze pohybovala svým σC-H elektrony na πC-C orbitální (obrázek 10).
 Obrázek 8: V E2 mechanismus, rozbíjející se vazba C – H a odstupující skupina jsou často antipiperipární. Na obrázku B je obecná báze a X je odstupující skupina. | 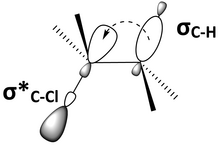 Obrázek 9: Orbitál vázající se na C – H se pomocí hyperkonjugace mísí s orbitálem vázajícím se na C – X. |  Obrázek 10: V E2 Molekuly mechanismu obecně upřednostňují anti-periplanární geometrii, protože srovnává molekulární orbitaly a nastavuje molekulu tak, aby pohybovala elektrony v orbitálu vázajícím C – H do πC-C spojovací orbitální. |
Pinacol přesmyk
V pinacol přesmyk, je methylová skupina nalezena jako antipiperiplanar k funkční skupině aktivovaného alkoholu.[10][11] Tím se umístí σC – C oběžná dráha methylové skupiny paralelně s σ *C – O orbitál aktivovaného alkoholu. Než aktivovaný alkohol odejde jako H2O, orbitál s methylovou vazbou se daruje do orbitalu s vazbou na CO, což oslabuje obě vazby. Tato hyperkonjugace usnadňuje posun 1,2-methylu, ke kterému dochází k odstranění vody. Viz obrázek 11 pro mechanismus.
Historie, etymologie a zneužití
Termín anti-periplanar poprvé vytvořili Klyne a Prelog ve své práci s názvem „Popis stérických vztahů napříč jednoduchými vazbami“, publikovanou v roce 1960.[12] Výraz „anti“ označuje dvě funkční skupiny ležící na opačných stranách roviny vazby. „Peri“ pochází z řeckého slova pro „blízko“, takže periplanar znamená „přibližně rovinný“.[13] Ve svém článku „Periplanar nebo Coplanar?“ Kane a Hersh poukazují na to, že mnoho organických učebnic používá anti-periplanar ve smyslu zcela antiplanárního nebo antikoplanárního, což je technicky nesprávné.[14]
Reference
- ^ Eliel, Ernest; Wilen, Samuel; Mander, Lewis (září 1994). Stereochemie organických sloučenin. New York: Wiley-Scientific. ISBN 978-0-471-01670-0.
- ^ Kane, Saul; Hersh, William (1. října 2000). „Periplanární nebo koplanární?“. Journal of Chemical Education. 77 (10): 1366. doi:10.1021 / ed077p1366.
- ^ Wikipedia, Dreamtheater v angličtině (9. srpna 2012), Angličtina: Ilustrace syn / anti peri / clinal nomenklatury molekulárních torzních konformací. Používá se na stránce Alkane stereochemistry., vyvoláno 17. března 2017
- ^ Wade, Leroy (6. ledna 2012). Organická chemie (8. vydání). Pearson. str.267 –268. ISBN 978-0321768414.
- ^ Carey, Francis; Sundberg, Richard (27. května 2008). Pokročilá organická chemie: Část A: Struktura a mechanismy (5. vydání). Springer. str.558 –563. ISBN 978-0387683461.
- ^ Deslongchamps, Ghislain; Deslongchamps, Pierre (12. května 2011). „Ohnuté vazby, antiperiplanární hypotéza a teorie rezonance. Jednoduchý model k pochopení reaktivity v organické chemii“. Organická a biomolekulární chemie. 9 (15): 5321–5333. doi:10.1039 / C1OB05393K. PMID 21687842.
- ^ Hunt, Iane; Spinney, Ricku. „Kapitola 5: Struktura a příprava alkenů. Eliminační reakce“. Citováno 13. března 2017.
- ^ Anslyn, Eric; Dougherty, Dennis (15. července 2005). Moderní fyzikální organická chemie. University Science. str.590 –592. ISBN 978-1891389313.
- ^ Rzepa, Henry (4. února 2012). „Orbitální analýza stereochemie eliminační reakce E2“. Citováno 13. března 2017.
- ^ Anslyn, Eric; Dougherty, Dennis (15. července 2005). Moderní fyzikální organická chemie. University Science. str.676 –677. ISBN 978-1891389313.
- ^ Carey, Francis; Sundberg, Richard (30. prosince 2010). Pokročilá organická chemie: Část B: Reakce a syntéza (5. vydání). Springer. str.883 –886. ISBN 978-0387683546.
- ^ Klyne, William; Prelog, Vladimir (1. prosince 1960). "Popis stérických vztahů napříč jednoduchými vazbami". Experientia. 16 (12): 521–523. doi:10.1007 / BF02158433.
- ^ Kane, Saul; Hersh, William (1. října 2000). „Periplanární nebo koplanární?“. Journal of Chemical Education. 77 (10): 1366. doi:10.1021 / ed077p1366.
- ^ Kane, Saul; Hersh, William (1. října 2000). „Periplanární nebo koplanární?“. Journal of Chemical Education. 77 (10): 1366. doi:10.1021 / ed077p1366.
