Úhelně rozlišená nízkokoherentní interferometrie - Angle-resolved low-coherence interferometry
Úhelně rozlišená nízkokoherentní interferometrie (a / LCI) se objevuje[když? ] biomedicínské zobrazování technologie, která využívá vlastnosti rozptýlené světlo měřit průměrnou velikost buněčných struktur, včetně buněčná jádra. Tato technologie slibuje jako klinický nástroj pro in situ detekce dysplastické nebo prekancerózní tkáň.
Úvod
A / LCI kombinuje nízkokoherentní interferometrie s úhlovým rozlišením rozptyl vyřešit inverzní problém stanovení geometrie rozptylu na základě vzdálené pole difrakční vzory. Podobně jako u reflektometrie optické koherentní domény (OCDR) a optická koherentní tomografie (OCT), a / LCI používá širokopásmový světelný zdroj v interferometrie schéma za účelem dosažení optického krájení s hloubkovým rozlišením stanoveným koherenční délka zdroje. Zachycení měření rozptylu s rozlišením úhlu světlo jako funkce úhlu rozptylu a převrácení úhlů odvodit průměrnou velikost rozptylových objektů pomocí výpočetní model rozptylu světla jako Teorie Mie, který předpovídá úhly na základě velikosti rozptylu koule. Kombinace těchto technik umožňuje konstrukci systému, který dokáže měřit průměrnou velikost rozptylu v různých hloubkách v rámci a vzorek tkáně.
V současné době je nejvýznamnější lékařskou aplikací této technologie určování stavu zdraví tkání na základě měření průměrné velikosti buněčných jader. Bylo zjištěno, že se změnou tkáně z normální na rakovinovou se zvyšuje průměrná velikost buněčných jader.[1] Několik nedávných studií [2] prokázali, že pomocí měření buněčných jader může a / LCI detekovat přítomnost dysplázie nízkého a vysokého stupně s 91% citlivostí a rozlišovat mezi normální a dysplastickou se 97% specificitou.
Dějiny
Od roku 2000 se systémy rozptylu světla používají pro biomedicínské aplikace, jako je studium buněk morfologie[3] stejně jako diagnóza dysplázie.[4] Variace v rozptylu distribucí jako funkce úhel nebo vlnová délka byly použity k odvození informací týkajících se velikosti buněk a subcelulárních objektů, jako jsou jádra a organely. Tato měření velikosti lze poté diagnosticky použít k detekci změn tkáně - včetně neoplastický změny (ty, které vedou k rakovině).
K detekci dysplázie v. Byla použita spektroskopie rozptylu světla dvojtečka, měchýř, čípek, a jícen lidských pacientů.[2] K detekci byl také použit rozptyl světla Barrettův jícen, metaplastický stav s vysokou pravděpodobností vedoucí k dysplazii.[5]
Na rozdíl od / LCI se však všechny tyto techniky spoléhají na měření založená na celkové intenzitě, kterým chybí schopnost poskytovat výsledky jako funkce hloubky v tkáni.
Rané modely / LCI
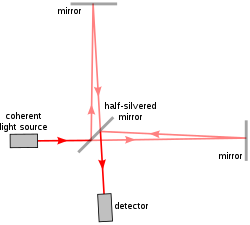
První implementace / LCI[6] použitý a Michelsonův interferometr, stejný model použitý ve slavném Michelson – Morleyův experiment. Michelsonův interferometr rozděluje jeden paprsek světla na dvě cesty, jednu referenční cestu a jednu cestu vzorkování a znovu je kombinuje, aby vytvořil vlnovou křivku vyplývající z rušení. Rozdíl mezi referenčním paprskem a vzorkovacím paprskem tak odhaluje vlastnosti vzorku tak, jak rozptyluje světlo.
Časné zařízení a / LCI používalo pohyblivé zrcadlo a čočku v referenčním rameni, aby vědci mohli replikovat různé úhly a hloubky v referenčním paprsku, jak se vyskytují ve shromážděném zpětně rozptýleném světle. To umožnilo izolaci zpětně rozptýleného světla v různých hloubkách odrazu ve vzorku. Za účelem transformace dat na měření buněčné struktury se poté porovná distribuce úhlového rozptylu s předpovědí Teorie Mie —Který vypočítá velikost koulí vzhledem k jejich vzorům rozptylu světla.
Technika a / LCI byla poprvé ověřena ve studiích polystyrenových mikrosfér,[6] jejichž velikosti byly známé a relativně homogenní. Pozdější studie rozšířila metodu zpracování signálu, aby kompenzovala nesférickou a nehomogenní povahu buněčných jader.[7]
Tento časný systém vyžadoval až 40 minut k získání dat o bodu 1 mm² ve vzorku, ale dokázal proveditelnost nápadu.
Implementace Fourierovy domény

Stejně jako OCT se rané implementace / LCI spoléhaly na fyzickou změnu délka optické dráhy (OPL) pro řízení hloubky ve vzorku, ze kterého jsou data získávána. Bylo to však prokázáno[8] že je možné použít a Fourierova doména implementace k získání hloubkového rozlišení při jediném sběru dat. A širokopásmové připojení světelný zdroj se používá k výrobě spektra vlnových délek najednou a zpětně rozptýlené světlo se shromažďuje pomocí a koherentní optické vlákno na zpáteční cestě k současnému zachycení různých úhlů rozptylu.[9] Intenzita se poté měří pomocí a spektrometr: jediný snímek ze spektrometru obsahuje intenzitu rozptylu jako funkci vlnová délka a úhel. Nakonec jsou data Fourier se transformoval na řádku po řádku pro generování intenzity rozptylu jako funkce OPL a úhlu. Ve výsledném snímku představuje osa x OPL a osa y úhel odrazu, čímž se získá 2D mapa intenzit odrazu.
Při použití této metody je rychlost snímání omezena pouze integrační dobou spektrometru a může být krátká při 20 ms. Stejná data, která původně vyžadovala získání desítek minut, lze získat ~ 105 krát rychlejší.[9]
Schematický popis

Verze systému Fourier s doménou systému / LCI používá a superluminiscenční dioda (SLD) s vláknovým výstupem jako zdroj světla. Rozdělovač vláken odděluje signální cestu při intenzitě 90% a referenční cestu při 10%.
Světlo z SLD prochází skrz optický izolátor a následně a polarizační řadič. Ukázalo se, že řízení polarizace světla je důležité pro maximalizaci optického signálu a porovnání úhlového rozptylu s modelem rozptylu Mie.[10] K přenosu osvětlení do vzorku se používá vlákno udržující polarizaci. Druhý polarizační řadič se podobně používá k řízení polarizace světla procházejícího referenční cestou.
Výstup vlákna vpravo je kolimoval pomocí čočky L1 a osvětluje tkáň. Ale protože je dodávací vlákno odsazeno od optické osy čočky, je paprsek dodáván do vzorku v šikmém úhlu. Zpětně rozptýlené světlo je pak kolimováno stejnou čočkou a shromažďováno svazkem vláken. Vlákna mají jednu ohniskovou vzdálenost od objektivu a vzorek má jednu ohniskovou vzdálenost na druhé straně. Tato konfigurace zachycuje světlo z maximálního rozsahu úhlů a minimalizuje světelný šum díky zrcadlovým odrazům.
Na distálním konci svazku vláken je světlo z každého vlákna zobrazeno na spektrometru. Světlo ze vzorku a referenčních ramen se mísí a dělení paprsků krychle (BS) a jsou dopadající na vstupní štěrbinu zobrazovacího spektrometru. Data ze zobrazovacího spektrometru jsou přenášena do počítače prostřednictvím Universal Serial Bus rozhraní pro zpracování signálu a zobrazení výsledků. Počítač také poskytuje kontrolu nad zobrazovacím spektrometrem.
Prototyp klinického zařízení

Systém a / LCI byl nedávno vylepšen, aby umožňoval provoz v a klinické prostředí s přidáním ruční hůlky. Pečlivým ovládáním polarizace v dodávacím vlákně, použitím vláken udržujících polarizaci a vložených polarizátorů umožňuje nový systém manipulaci s ruční hůlkou bez degradace signálu v důsledku účinků dvojlomů. Kromě toho nový systém využíval antireflexní vrstva kulová čočka ve špičce sondy, která snižuje odrazy, které jinak omezují rozsah hloubky systému.
Přenosný systém používá 2 stopy na 2 stopy optická prkénko jako základna, se zdrojem, optickými součástmi, čočkou, děličem paprsků a zobrazovacím spektrometrem namontovaným na prkénku. Hliníkový kryt chrání optiku. Vláknová sonda s ruční sondou umožňuje snadný přístup ke vzorkům tkáně pro testování. Na levé straně je bílá platforma pro vzorky, kde je umístěna tkáň pro testování. Ruční sonda je používána operátorem k výběru konkrétních míst na tkáni, ze kterých jsou odečítány hodnoty / LCI.
Viz také
- Aplikovaná spektroskopie
- Délka koherence
- Fourierova transformace
- Optická interferometrie
- Optická koherentní tomografie
- Antarctic Logistics Center International
Reference
- ^ Pyhtila, J; Chalut, K; Boyer, J; Keener, J; Damico, T; Gottfried, M; Gress, F; Wax, A (2007). „In situ detekce jaderné atypie v Barrettově jícnu pomocí úhlově rozlišené nízkokoherentní interferometrie“. Gastrointestinální endoskopie. 65 (3): 487–91. doi:10.1016 / j.gie.2006.10.016. PMID 17321252.
- ^ A b Wax, Adam; Pyhtila, John W .; Graf, Robert N .; Nines, Ronald; Boone, Charles W .; Dasari, Ramachandra R .; Feld, Michael S .; Steele, Vernon E .; Stoner, Gary D. (2005). „Prospektivní grading neoplastických změn v epitelu jícnu potkana pomocí interferometrie s nízkou koherencí s rozlišením úhlu“. Journal of Biomedical Optics. 10 (5): 051604. doi:10.1117/1.2102767. hdl:1721.1/87657. PMID 16292952.
- ^ Backman, V .; Gopal, V .; Kalashnikov, M .; Badizadegan, K .; Gurjar, R .; Wax, A .; Georgakoudi, I .; Mueller, M .; et al. (2001). "Měření buněčné struktury v submikrometrickém měřítku pomocí spektroskopie rozptylu světla". IEEE Journal of Selected Topics in Quantum Electronics. 7 (6): 887–893. doi:10.1109/2944.983289.
- ^ Wallace, M; Perelman, LT; Backman, V; Crawford, JM; Fitzmaurice, M; Seiler, M; Badizadegan, K; Shields, SJ; et al. (2000). „Endoskopická detekce dysplázie u pacientů s Barrettovým jícnem pomocí spektroskopie rozptylu světla“. Gastroenterologie. 119 (3): 677–82. doi:10.1053 / gast.2000.16511. PMID 10982761.
- ^ Lovat, Laurence B .; Pickard, David; Novelli, Marco; Ripley, Paul M .; Francis, Helen; Bigio, Irving J .; Bown, Stephen G. (04.04.2000). „4919 Nová technika optické biopsie využívající elastickou rozptylovou spektroskopii pro dysplazii a rakovinu v Barrettově jícnu“. Gastrointestinální endoskopie. 51 (4): AB227. doi:10.1016 / S0016-5107 (00) 14616-4. ISSN 0016-5107.
- ^ A b Wax, A; Yang, C; Backman, V; Kalashnikov, M; Dasari, RR; Feld, MS (2002). „Stanovení velikosti částic pomocí úhlové distribuce zpětně rozptýleného světla, měřeno interferometrií s nízkou koherencí“ (PDF). Journal of the Optical Society of America A. 19 (4): 737–44. doi:10.1364 / JOSAA.19.000737. PMID 11934166.
- ^ Wax, A; Yang, C; Backman, V; Badizadegan, K; Boone, CW; Dasari, RR; Feld, MS (2002). „Buněčná organizace a spodní struktura měřena pomocí interferometrie s nízkou koherencí s rozlišením úhlu“. Biofyzikální deník. 82 (4): 2256–64. doi:10.1016 / S0006-3495 (02) 75571-9. PMC 1302018. PMID 11916880.
- ^ Choma, M; Sarunic, M; Yang, C; Izatt, J (2003). "Výhoda citlivosti taženého zdroje a optické koherenční tomografie na Fourierově doméně" (PDF). Optika Express. 11 (18): 2183–9. doi:10.1364 / OE.11.002183. PMID 19466106.
- ^ A b Pyhtila, John W .; Boyer, Jeffrey D .; Chalut, Kevin J .; Wax, Adam (2006). „Fourier-domain úhel-rozlišená nízko koherentní interferometrie prostřednictvím endoskopického svazku vláken pro spektroskopii rozptylující světlo“. Optická písmena. 31 (6): 772–4. doi:10,1364 / OL.31.000772. PMID 16544619.
- ^ Pyhtila, John W .; Wax, Adam (2007). "Polarizační efekty na přesnost dimenzování rozptylovače analyzovány s interferencí s nízkou koherencí pomocí interferometrie s frekvenční doménou". Aplikovaná optika. 46 (10): 1735–41. doi:10,1364 / AO.46.001735. PMID 17356616.
