Acyldepsipeptidová antibiotika - Acyldepsipeptide antibiotics - Wikipedia
Acyldepsipeptid nebo cyklický acyldepsipeptid (ADEP) je třída potenciálu antibiotika nejprve izolován z bakterií a působí deregulací ClpP proteáza. Přírodní ADEPs byly původně nalezeny jako produkty aerobiku kvašení v Streptomyces hawaiiensis, A54556A a B,[1] a v kulturním vývaru Streptomyces druhy, enopeptin A a B.[2] ADEP mají velký zájem o vývoj léčiv kvůli jejich antibiotickým vlastnostem, a proto jsou upravováni ve snaze dosáhnout většího antimikrobiální aktivita.[3][4]
Potenciální role ADEP v boji proti rezistenci na antibiotika se předpokládá kvůli jejich novému mechanismu účinku, o kterém není známo, že používají jiná antibiotika, aktivaci kaseinové lytické proteázy (ClpP ), což je důležitá bakterie proteáza.[5][6] Většina antibiotik pracuje prostřednictvím inhibičních procesů k nastolení buněčné smrti, zatímco ADEPs ve skutečnosti působí aktivací proteázy a způsobují nekontrolovanou degradaci proteinů, inhibici buněčné dělení a následná buněčná smrt.[3][4][7] Do značné míry ovlivňují Grampozitivní bakterie[4] a může být velmi užitečné k cílení odolný vůči antibiotikům mikroby, jako jsou rezistentní na meticilin Zlatý stafylokok (MRSA ), rezistentní na penicilin Streptococcus pneumoniae (PRSP ), Mycobacterium tuberculosis, a další.[3][4] Navzdory možnému použití ADEP byla u některých druhů zkoumána možná rezistence.[8]
- Chemické struktury přírodních ADEP

Enopeptin A

Enopeptin B.
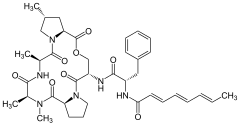
A54556A

A54556B
Mechanismus

Antibiotika ADEP lze použít k porážce rezistentních bakteriálních infekcí. Váží se na ClpP a umožňují proteáze degradovat proteiny bez pomoci ATPázy.[6][9][10] Komplexy ADEP4 / ClpP se zaměřují především na nově vytvořené proteiny a na FtsZ, který umožňuje dělení buněk. ClpP aktivní forma je tetradecamer složený ze dvou heptamerů, na které se váže 14 ADEP.[6]

ADEP se vážou v dutinách tvořených dvěma monomery ClpP.[6][11] Jejich vazebné místo je složeno z hydrofobních zbytků a odpovídá vazebným místům ClpP ATPáz. Po navázání dochází k posuvu sekundárních struktur z vnější oblasti do středu ClpP. To uvede flexibilní N-koncovou β-smyčku do neuspořádaného stavu. P-smyčky normálně tvoří bránu nad proteolytickým kanálem a zabraňují náhodnému průchodu proteinů. Jsou rozhodující pro interakci ClpP s jeho substrátem a ATPázami. Když se ADEP váže, β-smyčky se posouvají ven a to je doprovázeno posuny dvou α-šroubovic (α1 a α2), čtyř β-řetězců (β1, β2, β3 a β5) a dalších smyček, které vedou k otevření pór ClpP. Stručně řečeno, ADEP4 dereguluje funkci ClpP a změní ji z uzavřeného stavu na otevřený. V tomto okamžiku se jeho specifická proteolytická aktivita stává méně kontrolovaným procesem se zničením proteinů, které jsou v cílové buňce.
Peptidáza ClpP je vysoce konzervovaná v celém organismu a je přísně regulována.[4] Bez aktivace může ClpP za normálních podmínek degradovat krátké peptidy, které volně difundují do své vnitřní degradační komory.[12] Proteiny rodiny Clp jsou proteázy závislé na ATP, které hrají klíčovou roli ve funkci buněk degradací nesprávně složených proteinů.[9] ClpP je monomer sám o sobě, ale po navázání se oligomerizuje na tetradecamery ATPázy.[13] Potřebuje ATPázu k identifikaci, rozvinutí a přenosu cílených velkých proteinů do proteolytického kanálu.[6][9][11] Samotný ClpP může ve skutečnosti pouze degradovat peptidy které jsou dlouhé až šest aminokyselin.[13]Vazba ADEP indukuje ClpP proteolytický aktivace, která vede k degradaci proteinů v buňce, zejména rodící se bílkoviny a Ftsz protein, který je důležitým proteinem při dělení buněk.[6][9] To potenciálně vede k buněčné smrti a je to důvod, proč je ADEP slibnou technikou pro vývoj léků.
U složených proteinů, rozložených proteinů a dlouhých peptidů musí být ClpP aktivován proteinem v rodině ATPázy spojeným s různými buněčnými aktivitami (AAA proteiny ), jako je ClpA, ClpX nebo ClpC.[12] Tyto chaperonové proteiny jsou zodpovědní za hydrolyzující ATP na ADP, využití energie, a poté odebrání složených proteinů a jejich rozvinutí.[14] Dále Clp-ATPázy proklouzly rozložené proteiny do degradační komory v ClpP, což umožňuje procesní degradaci Podklad.[12][15] Tento proces je přísně regulován hydrolýzou ATP, aby se zabránilo nekontrolované degradaci proteinů nebo peptidů, které by byly pro buňku škodlivé.[4]
Naproti tomu ADEP aktivuje ClpP bez nutnosti hydrolýzy ATP, což způsobuje nekontrolovanou degradaci rozložených proteinů a peptidů v buňce.[12] Předpokládá se, že ADEP se mírně váží kooperativně na povrchu každého prstence ClpP v jeho hydrofobní kapsy a mít alosterický účinky při aktivaci ClpP.[12] Tato vazba iniciuje ClpP podstoupit a konformační změna takový, že jeho N-terminál Oblast otevírá své axiální póry, aby umožnila částečnou degradaci produktů ve srovnání s progresivní degradací s ClpA.[12] Aktivace ADEP ClpP ADEP neumožňuje degradaci složeného proteinu, ale i při degradaci složeného proteinu a peptidu ADEP stále způsobuje smrt bakteriálních buněk.[12]
Výzkum ukázal, že ClpP aktivovaný ADEP se zaměřuje spíše na buněčné dělení než na metabolické procesy.[7] Zdá se, že ADEP iniciuje ClpP, aby přednostně degradoval FtsZ, důležitý bakteriální protein podílející se na septum tvorba, která je nezbytná pro dělení bakteriálních buněk.[7] Výsledkem je, že grampozitivní bakterie ošetřené ADEP se tvoří dlouho vlákna před buněčnou smrtí.[4][7]
Výhody
Když jsou bakterie vystaveny antibiotikům, mohou se vůči antibiotiku stát rezistentními nebo tolerantními. ADEP mají velký potenciál pro klinické použití díky své vysoké antibakteriální aktivitě proti grampozitivním patogenům, jako je Staphylococcus aureus, a dalším patogenům, které se vyskytují v biofilmech a chronických infekcích. Jejich účinnost se zvyšuje v kombinaci s různými antibiotiky, jako je ciprofloxacin, linezolid, vankomycin nebo rifampicin.[9] Další studie by se měly více zaměřit na toxicitu ADEP a jejich implementaci pro klinické použití.
Aplikace
Poté, co byla v časopise Nature publikována dysregulace bakteriálního proteolytického aparátu novou třídou antibiotik, mnoho vědců začalo toto antibiotikum studovat. Většina experimentů se zaměřuje na to, jak komplex ADEPs / ClpP funguje, a na funkční rozdíl mezi ADEP a jeho syntetickým kongenery.
V roce 2011 provedl P. Sass a spolupracovníci výzkum zaměřený na interakci a funkci ADEP a ClpP. Vyvolali ADEP do Bacillus subtilis, Zlatý stafylokok a Streptococcus pneumoniae zjistit, jak ADEP vede ke smrti bakterií.[16] Výsledky prokázaly, že ADEP narušuje dělení bakteriálních buněk. Výzkumníci sledovali, aby zjistili důvod, proč ADEP inhiboval buněčné dělení septum tvorba a segregace nukleoidů v ADEP B. subtilis a ADEP S. aureus. The S. aureus a B. subtilis vzorky poskytly rovnocenné výsledky. Tato část ukázala důležitost divokého typu ClpP a inhibice tvorby septa je přímou interferencí ADEP se složkami buněčného dělení. Lokalizační studie proteiny buněčných dělení značených GFP prokázaly, že ADEP způsobuje delokalizaci Ftsz a inhibici sestavy Z-kruhu u obou druhů. Dopad ADEP na mutanta ∆clpX naznačil, že ADEP ovlivňuje buněčné dělení a že také inhibuje sestavení Z-kruhu. Nakonec vědci opakují experiment s mutantem ∆ClpP, aby potvrdili, že přítomnost ADEP snižuje počet FtsZ degradací ClpP.
V roce 2013 provedli vědci na Northeastern University experiment zaměřený na to, jak funguje ADEP 4 / ClpP.[9] Experimentální výsledky ukázaly účinnost ADEP4 v kombinaci s jinými antibiotiky. Vědci sledovali množství trypických peptidů a zjistili, že ADEP4 / ClpP indukuje degradaci peptidů v systému biofilmu. Použitím Mueller-Hintonova bujónu prokázali, že ADEP 4 byl účinnější než jiná antibiotika, jako je rifampicin nebo vankomycin. Pozorovali však stejné trendy, kde je ADEP4 v kombinaci s rifampicinem účinnější a ve skutečnosti odstraňuje všechny stacionární fáze. Výsledky in vitro ukázaly účinnost ADEP 4 u myší infikovaných 4 různými kmeny S. aureus, laboratorním kmenem SA113 a klinickými izoláty USA300, UAMS-1 a kmenem 37.
Chemie
ADEP jsou přirozeně se vyskytující antibiotika. Určité bakterie je produkují jako obranný mechanismus při antagonistických bakteriálních interakcích.[17] Například, Streptomyces druhy je produkují jako sekundární metabolity.[18]

Existuje 6 forem acyldepsipeptidů, které se liší svou chemickou strukturou a funkcí.[13] ADEP se obecně liší o jednu nebo dvě funkční skupiny, které některým z nich dodávají větší flexibilitu a stabilitu.[10] Jejich chemické struktury jsou odvozeny od ADEP 1 a navzájem se mírně liší.[6][13] Například jediným rozdílem mezi ADEP 2 a ADEP 3 je konformace postranního řetězce difluorfenylalaninu. ADEP 2 má S konfiguarion, zatímco ADEP 3 má R configuarion.[10]
Molekulární modifikace
Aby bylo možné vyvinout užitečné antibiotikum, ADEP se i nadále upravuje, aby se zvýšila antimikrobiální aktivita a stabilita. Omezením složek ADEP na snížení flexibility molekuly se zvýšila vazba a významně se zvýšila antimikrobiální aktivita.[3] Charakteristický aminokyseliny podstatné pro peptidolaktonové jádro ADEP byly pozměněny a omezeny, což způsobilo stabilizaci ADEP v bioaktivní konformaci.[3] Ve skutečnosti konformační omezení ADEP vyústila v jeho schopnost aktivovat ClpP sedmkrát a jeho antimikrobiální aktivita 1200krát.[3] Výzkum změn molekul ADEP pokračuje ve snaze vytvořit nové antibiotikum pro veřejné použití.
Reference
- ^ K. H. Michel, R. E. Kastner (Eli Lilly and Company), US 4492650, 1985 [Chem. Abstr. 1985, 102, 130459].
- ^ Osada, Hiroyuki; Yano, Tatsuya; Koshino, Hiroyuki; Isono, Kiyoshi (1991). „Enopeptin A, nové depsipeptidové antibiotikum s antibakteriofágovou aktivitou“. The Journal of Antibiotics. 44 (12): 1463–1466. doi:10,7164 / antibiotika. 44,1463. PMID 1778798.
- ^ A b C d E F Carney, Daniel W .; Schmitz, Karl R .; Truong, Jonathan V .; Sauer, Robert T .; Sello, Jason K. (2014). „Omezení konformační dynamiky cyklických acyldepsipeptidových antibiotik zlepšuje jejich antibakteriální aktivitu“. JACS. 136 (5): 1922–1929. doi:10.1021 / ja410385c. PMC 4004210. PMID 24422534.
- ^ A b C d E F G Hinzen, Berthold; Labischinski, Harald; Brötz-Oesterhelt, Heike; Endermann, Rainer; Benet-Buchholz, Jordi; Hellwig, Veronica; Häbich, Dieter; Schumacher, Andreas; Lampe, Thomas; Paulsen, Holger; Raddatz, Siegfried (2006). „Medicinal Chemistry Optimization of Acyldepsipeptides of the Enopeptin Class Antibiotics“. ChemMedChem. 1 (7): 689–693. doi:10,1002 / cmdc.200600055. PMID 16902918. S2CID 36525372.
- ^ Brötz-Oesterhelt, Heike; Beyer, D .; Kroll, H.P .; Enderman, R .; Ladel, C .; Schroeder, W .; Hinzen, B .; Raddatz, S .; Paulsen, H .; Henniger, K .; Bandow, J. E.; Sahl, H.G .; Labischinski, H. (2. října 2005). "Dysregulace bakteriálního proteolytického aparátu novou třídou antibiotik". Přírodní medicína. 11 (10): 1082–1087. doi:10,1038 / nm1306. PMID 16200071. S2CID 661201.
- ^ A b C d E F G Lee, BG; Park, EY; Lee, KE; Jeon, H; Sung, KH; Paulsen, H; Rübsamen-Schaeff, H; Song, HK (2010). „Struktury ClpP v komplexu s acyldepsipeptidovými antibiotiky odhalují jeho aktivační mechanismus“. Přírodní strukturní a molekulární biologie. 17 (4): 471–8. doi:10.1038 / nsmb.1787. PMID 20305655. S2CID 20029980.
- ^ A b C d Sass, Peter; Josten, Michaele; Famulla, Kirsten; Schiffer, Guido; Sahi, Hans-Georg; Hamoen, Leendert; Brotz-Oesterhelt, Heike (2011). „Antibiotika acyldepsipeptidy aktivují peptidázu ClpP k degradaci proteinu FtsZ buněčného dělení“. PNAS. 108 (42): 17474–17479. Bibcode:2011PNAS..10817474S. doi:10.1073 / pnas.1110385108. PMC 3198362. PMID 21969594.
- ^ Gominet, M .; Seghezzi, N .; Mazodier, P. (2011). „Acyl-depsipeptidová (ADEP) rezistence na Streptomyces“. Mikrobiologie. 157 (8): 2226–2234. doi:10.1099 / mic.0.048454-0. PMID 21636652.
- ^ A b C d E F Conlon, B.P .; Nakayasu, E. S .; Fleck, L. E.; LaFleur, M. D .; Isabella, V. M .; Coleman, K .; Leonard, S. N .; Smith, R. D .; Adkins, J. N .; Lewis, K. (21. listopadu 2013). „Aktivovaný ClpP zabíjí perzistující látky a likviduje chronickou infekci biofilmem“. Příroda. 503 (7476): 365–370. Bibcode:2013Natur.503..365C. doi:10.1038 / příroda12790. PMC 4031760. PMID 24226776.
- ^ A b C Hinzen, B .; Raddatz, S .; Paulsen, H .; Lampe, T .; Schumacher, A .; Häbich, D .; Hellwig, V .; Bennet-Buchholz, J .; Endermann, R .; Labischinski, H .; Brötz-Oesterhelt, H. (10. července 2006). „Optimalizace lékařské chemie acyldepsipeptidů antibiotik třídy Enopeptin“. ChemMedChem. 1 (7): 689–693. doi:10,1002 / cmdc.200600055. PMID 16902918. S2CID 36525372.
- ^ A b Li, D.H .; Chung YS; Gloyd M; Joseph E; Ghirlando R; Wright GD; Cheng YQ; Maurizi MR; Guarné A; Ortega J. (24. září 2010). „Acyldepsipeptidová antibiotika indukují tvorbu strukturovaného axiálního kanálu v ClpP: Model stavu vázaného na ClpX / ClpA ClpP“. Chemie a biologie. 17 (9): 959–969. doi:10.1016 / j.chembiol.2010.07.008. PMC 2955292. PMID 20851345.
- ^ A b C d E F G Li; Him Shun, Dominic; Guarné, Alba; Maurizi, Michael R .; Cheng, Yi-Qiang; Wright, Gerard D .; Ghirlando, Rodolfo; Joseph, Ebenezer; Gloyd, Melanie; Seon Chung, Yu; Ortega, Joaquin (2010). „Acyldepsipeptidová antibiotika indukují tvorbu strukturovaného axiálního kanálu v ClpP: model stavu ClpX vázaného na ClpX / ClpA“. Chemie a biologie. 17 (9): 959–969. doi:10.1016 / j.chembiol.2010.07.008. PMC 2955292. PMID 20851345.
- ^ A b C d Kirstein, J .; Hoffmann A; Lilie H; Schmidt R; Rübsamen-Waigmann H; Brötz-Oesterhelt H; Mogk A; Turgay K (2009-03-26). „Antibiotikum ADEP přeprogramuje ClpP a přepne jej z regulované na nekontrolovanou proteázu“. EMBO Molekulární medicína. 1 (1): 37–49. doi:10,1002 / emmm.200900002. PMC 3378108. PMID 20049702. Zpřístupněno 6. 4. 2016.
- ^ Hoskins, J. R. (1998). „Role chaperonu ClpA v proteolýze pomocí ClpAP“. Sborník Národní akademie věd. 95 (21): 12135–12140. Bibcode:1998PNAS ... 9512135H. doi:10.1073 / pnas.95.21.12135. PMC 22797. PMID 9770452.
- ^ Ishikawa, T .; Beuron, F .; Kessel, M .; Wickner, S .; Maurizi, M .; Steven, A. (2001). „Translokační dráha proteinových substrátů v proteáze ClpAP“. Sborník Národní akademie věd. 98 (8): 4328–4333. Bibcode:2001PNAS ... 98,4328I. doi:10.1073 / pnas.081543698. PMC 31834. PMID 11287666.
- ^ Sass, Peter; Josten, Michaele; Famulla, Kirsten; Schiffer, Guido; Sahl, Hans-Georg; Ha, Leendert; Börtz-Oesterhelt, Heike (2011). „Antibiotická acyldepsipeptidy aktivují peptidázu ClpP k degradaci proteinu FtsZ buněčného dělení“. Sborník Národní akademie věd Spojených států amerických. 108 (42): 17474–17479. Bibcode:2011PNAS..10817474S. doi:10.1073 / pnas.1110385108. PMC 3198362. PMID 21969594.
- ^ Stacey, Kevine. „Chytrá chemie a nová třída antibiotik“. Brown University. Citováno 2014-03-15.
- ^ Xu, S .; Guo, P .; Gao, Y .; Shi, Q .; On, D .; Gao, Y .; Zhang, H. (2013). „Acyldepsipeptidy inhibují růst renálních rakovinných buněk zastavením buněčného cyklu ve fázi G1“. Sdělení o biochemickém a biofyzikálním výzkumu. 438 (3): 468–472. doi:10.1016 / j.bbrc.2013.07.119. PMID 23928161.
Další čtení
- Molekulární popis ADEP1




