Zeotropní směs - Zeotropic mixture
tento článek možná matoucí nebo nejasné čtenářům. (Leden 2012) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
A zeotropní směs, nebo neazeotropní směs, je směs se složkami, které mají různé body varu.[1] Například dusík, methan, ethan, propan a isobutan tvoří zeotropní směs.[2] Jednotlivé látky ve směsi nejsou odpaří se nebo kondenzovat při stejné teplotě jako jedna látka.[3] Jinými slovy, směs má teplotní skluz jako změna fáze se vyskytuje spíše v teplotním rozmezí asi čtyř až sedmi stupňů Celsia než při konstantní teplotě.[3] Na grafech teplotního složení lze tento teplotní skluz považovat za teplotní rozdíl mezi bublinový bod a rosný bod.[4] U zeotropních směsí jsou teploty na bublinové (varné) křivce mezi teplotami varu jednotlivých složek.[5] Když se zeotropní směs vaří nebo kondenzuje, mění se složení kapaliny a páry podle diagramu teplotního složení směsi.[5]
Zeotropní směsi mají různé vlastnosti v nukleátovém a konvekčním varu, stejně jako v organický Rankinův cyklus. Protože zeotropní směsi mají jiné vlastnosti než čisté tekutiny nebo azeotropické směsi, zeotropní směsi mají mnoho jedinečných aplikací v průmyslu, zejména v destilačních, chladicích a čisticích procesech.
Rosné a bublinkové body
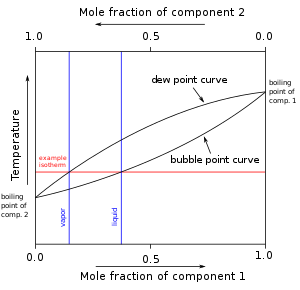
Ve směsích látek je bodem bubliny teplota nasycené kapaliny, zatímco teplota nasycených par se nazývá rosný bod. Protože bublinové a rosné čáry diagramu teplotního složení zeotropické směsi se neprotínají, má zeotropní směs v kapalné fázi jiný podíl složky než plynná fáze směsi.[4] Na diagramu teplotního složení se po zahřátí směsi v kapalné fázi na teplotu na bublinové (varné) křivce změní podíl složky ve směsi podél izotermické linie spojující rosnou křivku s křivkou varu jako směs se vaří.[4] Při jakékoli dané teplotě je složení kapaliny složení v bodě bubliny, zatímco složení páry je složení v rosném bodě.[5] Na rozdíl od azeotropních směsí neexistuje v diagramu při žádné teplotě žádný azeotropní bod, kde by se protínala bublinová a rosná čára.[4] Složení směsi se tedy vždy změní mezi frakcemi bublinové a rosné složky při varu z kapaliny na plyn, dokud hmotnostní zlomek složky nedosáhne 1 (tj. Zeotropní směs se úplně rozdělí na čisté složky). Jak je uvedeno v Obrázek 1, jak se kapalná směs vaří do plynné fáze, molární podíl složky 1 klesá z 0,4 na přibližně 0,15.
Teplotní klouzání
Různé zeotropní směsi mají různé teplotní klouzání. Například zeotropní směs R152a / R245fa má klouzavost vyšší teploty než R21 / R245fa.[7] Větší mezera mezi body varu vytváří větší teplotní skluz mezi křivkou varu a rosnou křivkou při daném hmotnostním zlomku.[4] S jakoukoli zeotropní směsí však pokles teploty klesá, když se hmotnostní zlomek složky blíží 1 nebo 0 (tj. Když je směs téměř rozdělena na čisté složky), protože křivky varu a rosy se blíží těmto hmotnostním zlomkům.[4]
Větší rozdíl v bodech varu mezi látkami také ovlivňuje rosné a bublinkové křivky grafu.[4] Větší rozdíl v bodech varu vytváří větší posun v hmotnostních frakcích, když směs vře při dané teplotě.[4]
Zeotropní vs. azeotropní směsi
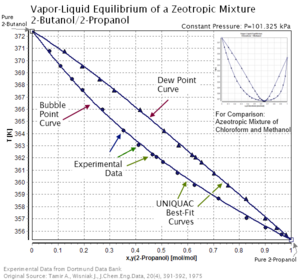
Azeotropické a zeotropní směsi mají v grafu složení teploty různé charakteristiky křivek rosy a bublin.[4] Azeotropické směsi mají křivky rosy a bublin, které se protínají, ale zeotropní směsi nikoli.[4] Jinými slovy, zeotropní směsi nemají žádné azeotropní body.[4] Azeotropická směs, která je blízko svého azeotropního bodu, má zanedbatelné zeotropní chování a je spíše azeotropní než zeotropní.[5]
Zeotropní směsi se od azeotropních směsí liší v tom, že parní a kapalná fáze azeotropické směsi mají stejný podíl složek.[9] To je způsobeno stálým bodem varu azeotropické směsi.[9]
Vařící
Když přehřátí látka, nukleátový bazén vroucí a konvektivní proudění varu nastává, když je teplota povrchu používaného k ohřevu kapaliny vyšší než teplota varu kapaliny přehřátím stěny.[10]
Nukleátový bazén vaří
Vlastnosti varu v bazénu se u zeotropních směsí liší od vlastností čistých směsí.[11] Například minimální přehřátí potřebné k dosažení tohoto varu je větší pro zeotropní směsi než pro čisté kapaliny kvůli rozdílným podílům jednotlivých látek v kapalné a plynné fázi zeotropní směsi.[11] Zeotropní směsi a čisté kapaliny mají také různé kritické tepelné toky.[11] Kromě toho koeficienty přenosu tepla zeotropních směsí je méně než ideální hodnoty předpovídané pomocí koeficientů čistých kapalin.[11] Toto snížení přenosu tepla je způsobeno skutečností, že koeficienty přenosu tepla zeotropních směsí se nezvyšují úměrně s hmotnostními frakcemi složek směsi.[11]
Konvekční průtokový var
Zeotropní směsi mají v konvekčním varu jiné vlastnosti než čisté látky nebo azeotropické směsi.[11] Celkově zeotropní směsi přenášejí teplo efektivněji na dno tekutiny, zatímco čisté a azeotropní látky přenášejí teplo lépe nahoře.[11] Během konvektivního průtokového varu je tloušťka kapalného filmu z důvodu gravitace menší v horní části filmu než ve spodní části.[11] V případě čistých kapalin a azeotropních směsí způsobí toto zmenšení tloušťky pokles odolnosti proti přenosu tepla.[11] Přenáší se tedy více tepla a koeficient přenosu tepla je vyšší v horní části fólie.[11] U zeotropních směsí je tomu naopak.[11] Snížení tloušťky filmu v horní části způsobuje, že složka ve směsi s vyšším bodem varu klesá v hmotnostním podílu.[11] Odpor vůči přenosu hmoty se tedy zvyšuje v blízkosti horní části kapaliny.[11] Přenáší se méně tepla a koeficient přenosu tepla je nižší než ve spodní části kapalného filmu.[11] Protože dno kapaliny přenáší teplo lépe, vyžaduje pro vaření zeotropní směsi nižší teplotu stěny v blízkosti dna než v horní části.[11]
Součinitel přestupu tepla
Od nízkých kryogenních až po pokojové teploty jsou koeficienty přenosu tepla zeotropních směsí citlivé na složení směsi, průměr varné trubice, tepelné a hmotnostní toky a drsnost povrchu.[2] Kromě toho ředění zeotropní směsi snižuje koeficient přenosu tepla.[2] Snížení tlaku při varu směsi pouze mírně zvyšuje koeficient.[2] Použití drážkovaných spíše než hladkých varných trubek zvyšuje koeficient přenosu tepla.[12]
Destilace

Ideální případ destilace používá zeotropní směsi.[14] Zeotropní tekutinu a plynné směsi lze oddělit pomocí destilace kvůli rozdílu v bodech varu mezi směsmi složek.[14][15] Tento proces zahrnuje použití vertikálně uspořádaných destilační kolony (vidět Obrázek 2).[15]
Destilační kolony
Při oddělování zeotropních směsí třemi nebo více kapalnými složkami odstraňuje každá destilační kolona pouze složku s nejnižší teplotou varu a složku s nejvyšší teplotou varu.[15] Jinými slovy, každý sloupec čistě odděluje dvě složky.[14] Pokud jsou tři látky odděleny jedním sloupcem, látka s mezibodem varu nebude čistě oddělena,[14] a bude zapotřebí druhý sloupec.[14] K oddělení směsí složených z více látek je nutné použít sekvenci destilačních kolon.[15] Tento vícestupňový destilační proces se také nazývá rektifikace.[15]
V každé destilační koloně se tvoří čisté složky v horní části (usměrňovací část) a spodní části (stripovací část) kolony, když se ve středu kolony uvolňuje výchozí kapalina (nazývaná surovinová směs).[15] To je uvedeno v Obrázek 2. Při určité teplotě složka s nejnižším bodem varu (tzv. Destilát nebo horní frakce) odpařuje se a shromažďuje se v horní části kolony, zatímco složka s nejvyšší teplotou varu (nazývaná dna nebo spodní frakce) se shromažďuje v dolní části kolony.[15] V zeotropní směsi, kde existuje více než jedna složka, se jednotlivé složky navzájem pohybují, jak páry proudí nahoru a kapalina klesá dolů.[15]
Oddělení směsí lze vidět na koncentračním profilu. V koncentračním profilu je poloha páry v destilační koloně vynesena proti koncentraci páry.[15] Složka s nejvyšší teplotou varu má maximální koncentraci ve spodní části kolony, kde složka s nejnižší teplotou varu má maximální koncentraci v horní části kolony.[15] Složka se středním bodem varu má maximální koncentraci ve středu destilační kolony.[15] Kvůli tomu, jak se tyto směsi oddělují, vyžadují směsi s více než třemi látkami k oddělení složek více než jednu destilační kolonu.[15]
Konfigurace destilace
K rozdělení směsí na stejné produkty lze použít mnoho konfigurací, i když některá schémata jsou efektivnější a pro dosažení různých potřeb se používají různá řazení sloupců.[14] Například zeotropní směs ABC může být nejprve rozdělena na A a BC před oddělením BC na B a C.[14] Na druhou stranu lze směs ABC nejprve rozdělit na AB a C a AB lze nakonec rozdělit na A a B.[14] Tyto dvě konfigurace jsou konfigurace s ostrým rozdělením, ve kterých meziprodukt varu nekontaminuje každý separační krok.[14] Na druhou stranu, směs ABC mohla být nejprve rozdělena na AB a BC a nakonec rozdělena na A, B a C ve stejném sloupci.[14] Jedná se o neostrou dělenou konfiguraci, ve které je látka s přechodným bodem varu po separačním kroku přítomna v různých směsích.[14]
Optimalizace účinnosti
Při navrhování destilačních procesů pro separaci zeotropních směsí je sekvenování destilačních kolon zásadní pro úsporu energie a nákladů.[16] Kromě toho lze použít jiné metody ke snížení nákladů na energii nebo zařízení potřebných k destilaci zeotropních směsí.[16] To zahrnuje kombinování destilačních kolon, použití postranních sloupců, kombinování hlavních sloupců s postranními sloupci a opětovné použití odpadní teplo pro systém.[16] Po zkombinování destilačních kolon je množství použité energie pouze v jedné oddělené koloně, nikoli v obou kolonách dohromady.[16] Kromě toho použití postranních sloupců šetří energii tím, že brání tomu, aby různé sloupce prováděly stejnou separaci směsí.[16] Kombinace hlavních a bočních sloupů šetří náklady na zařízení snížením počtu výměníků tepla v systému.[16] Opětovné použití odpadního tepla vyžaduje množství tepla a teplotní úrovně odpadu, aby odpovídaly potřebnému teplu.[16] Využití odpadního tepla tedy vyžaduje změnu vnitřního tlaku výparníky a kondenzátory destilačního systému za účelem kontroly potřebných teplot.[16] Ovládání úrovní teploty v části systému je možné pomocí Pinch Technology.[17] Tyto techniky úspory energie mají široké uplatnění v průmyslové destilaci zeotropních směsí: k rafinaci byly použity boční kolony ropa a stále častěji se používá kombinace hlavních a bočních sloupů.[16]
Příklady zeotropních směsí
Příklady destilace pro zeotropní směsi lze nalézt v průmyslu. Rafinace ropy je příkladem vícesložkové destilace v průmyslu, která se používá již více než 75 let.[14] Surová ropa je rozdělena na pět složek s hlavním a bočními sloupy v ostré rozdělené konfiguraci.[14] Kromě toho se ethylen odděluje od methanu a etanu pro průmyslové účely pomocí vícesložkové destilace.[14]
Oddělení aromatických látek vyžaduje extrakční destilaci, například destilaci zeotropní směsi benzenu, toluenu a p-xylenu.[14]
Chlazení
Zeotropickým směsím, které se používají v chlazení, je v řadě 400 přiřazeno číslo, které pomáhá identifikovat jeho složku a její podíly jako součást nomenklatury. Zatímco pro azeotropické směsi je jim přiděleno číslo ze série 500. Podle ASHRAE, názvy chladiv začínají písmenem „R“, za kterým následuje řada čísel - řada 400, pokud je zeotropní, nebo 500, pokud je aotropická - následovaná velkými písmeny, která označují složení.[18]
Výzkum navrhuje použití zeotropních směsí jako náhražek halogenovaných chladiva z důvodu škodlivých účinků, které obsahují hydrochlorfluoruhlovodíky (HCFC) a chlorfluoruhlovodíky (CFC) mají na ozónová vrstva a globální oteplování.[3] Vědci se zaměřili na používání nových směsí, které mají stejné vlastnosti jako předchozí chladiva, k postupnému vyřazování škodlivých halogenovaných látek v souladu s Montrealský protokol a Kjótský protokol.[3] Vědci například zjistili, že zeotropní směs R-404A může nahradit R-12, CFC, v chladničkách pro domácnost.[19] Existují však určité technické potíže při používání zeotropních směsí.[3] To zahrnuje úniky a klouzavost při vysokých teplotách spojené s látkami s různými body varu,[3] ačkoli lze klouzavost teploty přizpůsobit teplotnímu rozdílu mezi dvěma chladivy při výměně tepla pro zvýšení účinnosti.[5] Nahrazení čistých chladiv směsemi vyžaduje další výzkum dopadů na životní prostředí a také hořlavosti a bezpečnosti směsí chladiv.[3]
Organický Rankinův cyklus
V Organický Rankinův cyklus (ORC), zeotropní směsi jsou tepelně účinnější než čisté tekutiny.[20][21] Vzhledem k jejich vyšším bodům varu zeotropní pracovní kapaliny mají vyšší čisté výstupy energie při nízkých teplotách Rankinova cyklu než čisté látky.[7][21] Zeotropní pracovní kapaliny kondenzují v různých teplotách, což umožňuje externím tepelným výměníkům zpětné získávání kondenzovaného tepla jako zdroje tepla pro Rankinův cyklus.[20] Měnící se teplota zeotropní pracovní tekutiny může být přizpůsobena teplotě ohřívané nebo chlazené tekutiny, aby se ušetřilo odpadní teplo, protože proces odpařování směsi probíhá při teplotním skluzu[20][21] (vidět Analýza sevření ).
R21 / R245fa a R152a / R245fa jsou dva příklady zeotropních pracovních tekutin, které díky zvýšeným bodům varu mohou absorbovat více tepla než čistý R245fa.[7] Výkon se zvyšuje s podílem R152a v R152a / R245fa.[20] R21 / R245fa spotřebovává méně tepla a energie než R245fa.[7] Celkově má zeotropní směs R21 / R245fa lepší termodynamické vlastnosti než čistá R245fa a R152a / R245fa jako pracovní tekutina v ORC.[7]
Čisticí procesy
Zeotropní směsi lze použít jako rozpouštědla při čisticích procesech ve výrobě.[22] Čisticí procesy, které používají zeotropní směsi, zahrnují procesy spolurozpouštědla a procesy rozpouštědla.[22]
Procesy spolurozpouštědla a rozpouštědel
V systému spolurozpouštědla se mísí dvě mísitelné kapaliny s různými teplotami varu za vzniku zeotropní směsi.[22][23] První tekutinou je solvatační činidlo, které rozpouští půdu v procesu čištění.[22][23] Tato kapalina je organické rozpouštědlo s nízkým bodem varu a bodem vzplanutí vyšším, než je provozní teplota systému.[22][23] Poté, co se rozpouštědlo smísí s olejem, se druhá kapalina, proplachovací činidlo hydrofluorether (HFE), propláchne solvatační látkou.[22][23] Solvatační činidlo může být hořlavé, protože jeho směs s HFE je nehořlavá.[23] Při čištění pomocí rozpouštědel se oplachovací činidlo oddělí od rozpouštědla.[22] Díky tomu jsou solvatační a oplachovací prostředky účinnější, protože nejsou ředěny.[22]
Systémy spolurozpouštědel se používají pro těžké oleje, vosky, tuky a otisky prstů,[22][23] a může odstranit těžší půdy než procesy, které používají čistá nebo azeotropická rozpouštědla.[23] Systémy spolurozpouštědel jsou flexibilní v tom, že lze použít různé poměry látek v zeotropní směsi k uspokojení různých účelů čištění.[23] Například zvýšení podílu solvatačního činidla na oplachovacím prostředku ve směsi zvyšuje solventnost, a proto se používá k odstraňování těžších půd.[22][23]
Provozní teplota systému závisí na teplotě varu směsi,[23] což zase závisí na složení těchto látek v zeotropní směsi. Protože zeotropní směsi mají různé teploty varu, mají čisticí a oplachovací jímky různé poměry čisticích a solvatačních činidel.[23] Solvatační činidlo s nízkou teplotou varu se v proplachovací vaně nenachází kvůli velkému rozdílu v bodech varu mezi činidly.[23]
Příklady zeotropních rozpouštědel
Směsi obsahující HFC-43-10mee mohou nahradit CFC-113 a perfluorovaný uhlovodík (PFC) jako rozpouštědla v čisticích systémech, protože HFC-43-10mee na rozdíl od CFC-113 a PFC nepoškozuje ozonovou vrstvu.[23] Různé směsi HFC-43-10mee jsou komerčně dostupné pro různé čisticí účely.[23] Mezi příklady zeotropních rozpouštědel v čisticích procesech patří:
- Zeotropní směsi HFC-43-10mee a hexamethyldisiloxan mohou rozpouštět silikony a jsou vysoce kompatibilní s polykarbonáty a polyurethanem.[23] Mohou být použity k odstranění silikonového maziva ze zdravotnických prostředků.[23]
- Zeotropní směsi HFC-43-10mee a isopropanol dokáže odstranit ionty a vodu z materiálů bez porézních povrchů.[23] Tato zeotropní směs pomáhá při absorpčním sušení.[23]
- Zeotropní směsi HFC-43-10mee, fluorosurfaktant, a antistatický přísady jsou energeticky účinné a ekologicky nezávadné sušicí kapaliny, které poskytují sušení bez skvrn.[23]
Viz také
Reference
- ^ Gašpar; Pedro Dinis; da Silva; Pedro Dinho (2015). Příručka pro výzkum pokroků a aplikací v chladicích systémech a technologiích. IGI Global. str. 244. ISBN 978-1-4666-8398-3. Citováno 23. ledna 2017.
- ^ A b C d Barraza, Rodrigo; Nellis, Gregory; Klein, Sanford; Reindl, Douglas (2016). "Měřené a předpovídané koeficienty přenosu tepla pro vaření zeotropních směsných chladiv ve vodorovných trubkách". International Journal of Heat and Mass Transfer. 97: 683–695. doi:10.1016 / j.ijheatmasstransfer.2016.02.030.
- ^ A b C d E F G Mohanraj, M .; Muraleedharan, C .; Jayaraj, S. (2011-06-25). „Přehled nedávného vývoje nových směsí chladiv pro chladicí, klimatizační a tepelné čerpadlo založené na kompresi par“. International Journal of Energy Research. 35 (8): 647–669. doi:10.1002 / er.1736. ISSN 1099-114X.
- ^ A b C d E F G h i j k Herold, Keith; Radermacher, Reinhard; Klein, Sanford (04.04.2016). Absorpční chladiče a tepelná čerpadla, druhé vydání. CRC Press. 23–63. doi:10.1201 / b19625-4. ISBN 9781498714341.
- ^ A b C d E Sweeney, K.A .; Chato, J.C. (květen 1996). „Chování při přenosu tepla a poklesu tlaku zeotropické směsi chladiva v trubce s mikroskopickými vlákny“ (PDF). Klimatizační a chladicí centrum.
- ^ Padleckas, H. (10.11.2010). Wikimedia Commons.
- ^ A b C d E Pati, Soobhankar; Drelich, Jaroslaw; Jha, Animesh; Neelameggham, Neale; Prentice, Leon; Wang, Cong (2013). Energetická technologie 2013 - správa oxidu uhličitého a další technologie. Společnost minerálů, kovů a materiálů. ISBN 978-1-11860-571-4.
- ^ Wilfried, C. (2011-10-18). Wikimedia Commons.
- ^ A b Cleveland, J. Cutler; Morris, Christopher (01.01.2009). Slovník energie. Elsevier. str. 34. ISBN 9780080964911. OCLC 890665370 - přes Knovel.
- ^ Atkins, Tony; Escudier, Marcel (2013). Slovník strojírenství. Oxford University Press. doi:10.1093 / acref / 9780199587438.001.0001. ISBN 9780199587438.
- ^ A b C d E F G h i j k l m n Ó Radermacher, Reinhard; Hwang, Yunho (2005). Parní kompresní tepelná čerpadla se směsmi chladiva. Boca Raton, Florida: Taylor & Francis. 237–244. ISBN 9781420037579.
- ^ Zhang, Xiaoyan; Ji, Changfa; Yuan, Xiuling (01.10.2008). „Predikční metoda pro odpařovací přenos tepla neazotropních směsí chladiva proudících uvnitř trubek s vnitřními drážkami“. Aplikovaná tepelná technika. 28 (14–15): 1974–1983. doi:10.1016 / j.applthermaleng.2007.12.009.
- ^ Petrus, Anthony (01.11.2009). Wikimedia Commons.
- ^ A b C d E F G h i j k l m n Ó Górak, Andrzej; Sorensen, Eva (2014). Destilace: Základy a zásady. Elsevier. str. 271–300. ISBN 978-0-12-386547-2.
- ^ A b C d E F G h i j k l Stichlmair, Johann (2000). Destilace, 1. Základy. Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 9783527306732.
- ^ A b C d E F G h i Stichlmair, Johann (01.01.2000). „Destilace, 3. procesy“. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. doi:10.1002 / 14356007.o08_o02. ISBN 9783527306732.
- ^ Asprion, Norbert; Mollner, Stephanie; Poth, Nikolaus; Rumpf, Bernd (01.01.2000). Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. doi:10.1002 / 14356007.b03_12.pub2. ISBN 9783527306732.
- ^ Hundy, G. F .; Trott, A. R .; Welch, T. C. (2016). Chlazení, klimatizace a tepelná čerpadla. Elsevier. ISBN 978-0-08-100647-4 - přes Knovel.
- ^ Večeře, Ibrahim (01.01.2000). "Chlazení". Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002 / 0471238961.1805061819090212.a01.pub2. ISBN 9780471238966.
- ^ A b C d Wang, J.L .; Zhao, L .; Wang, X.D. (Listopad 2010). „Srovnávací studie čistých a zeotropních směsí v nízkoteplotním solárním Rankinově cyklu“. Aplikovaná energie. 87 (11): 3366–3373. doi:10.1016 / j.apenergy.2010.05.016.
- ^ A b C Aghahosseini, S .; Večeře, I. (květen 2013). "Srovnávací analýza výkonu nízkoteplotního organického Rankinova cyklu (ORC) s použitím čistých a zeotropních pracovních tekutin". Aplikovaná tepelná technika. 54 (1): 35–42. doi:10.1016 / j.applthermaleng.2013.01.028.
- ^ A b C d E F G h i j Owens, JohnG (04.04.2011). Příručka pro kritické čištění. CRC Press. str. 115–129. doi:10.1201 / b10897-7. ISBN 9781439828274.
- ^ A b C d E F G h i j k l m n Ó p q r s Kanegsberg, Barbara; Burke, John; Bockhorst, Rick; Beeks, Michael; Keller, David; Agopovich, JohnW; Owens, JohnG; Obchodník, Abid; Shubkin, RonaldL (2000-12-26). Příručka pro kritické čištění. CRC Press. doi:10.1201 / 9781420039825.sec1. ISBN 9780849316555.
