Trithionát - Trithionate
 | |
| Jména | |
|---|---|
| Název IUPAC 2,2,4,4-tetraoxido-1,5-dioxy-2,3,4-trisulfy- [5] catenát (2-) | |
| Identifikátory | |
3D model (JSmol ) | |
| 3DMet | |
| ChEBI | |
| ChemSpider | |
| 142337 | |
| KEGG | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
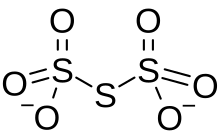
| Ó6S3−2 | |
| Molární hmotnost | 192.18 g · mol−1 |
| Konjugovaná kyselina | Trithionát vodíku |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Trithionát je oxyanion z síra s chemickým vzorcem [S3Ó6]2−. To je konjugovaná báze kyseliny trithionové. Zředěný NaOH hydrolyzuje S4N4 následujícím způsobem, čímž se získá thiosíran a trithionát:
2 S4N4 + 6 OH− + 9 H2O → S2O2−3 + 2 S3O2−6 + 8 NH3[1] Určitý bakterie snižující síran je známo, že používají sloučeninu v dýchání.[2]
Reference
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Oltmann, L. F .; Stouthamer, A. H. (1975-10-27). "Snížení tetrathionátu, trithionátu a thiosíranu a oxidace sulfidu v proteus mirabilis". Archiv mikrobiologie. 105 (2): 135–142. ISSN 0302-8933. PMID 1106343.
| Tento chemie související článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
