Fáze fluoru - Phases of fluorine
Fluor formuláře rozsivkové molekuly (F
2), které jsou při pokojové teplotě plynné a mají hustotu asi 1,3krát větší než hustota vzduchu.[1][poznámka 1] Ačkoli je někdy uváděn jako žlutozelený, čistý plynný fluor je ve skutečnosti velmi bledě žlutý. Barvu lze pozorovat pouze v koncentrovaném plynném fluoru, když se díváme dolů podél osy dlouhých trubic, protože se jeví jako průhledná, když je pozorována ze strany v normálních trubkách nebo pokud je umožněno uniknout do atmosféry.[3] Prvek má „štiplavý“ charakteristický zápach, který je patrný již při koncentracích 20ppb.[Citace je zapotřebí ]


Fluor kondenzuje na jasně žlutou kapalinu při -188 ° C (-307 ° F),[4] což je blízko kondenzačních teplot kyslíku a dusíku.
Pevný stav fluoru závisí na Van der Waalsovy síly držet molekuly pohromadě,[Citace je zapotřebí ] které kvůli malé velikosti fluor molekuly, jsou relativně slabé. V důsledku toho je pevný stav fluoru více podobný kyslíku nebo vzácným plynům než těžším halogenům.[Citace je zapotřebí ]

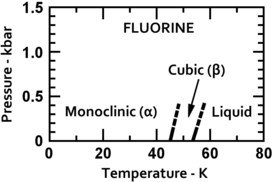
Fluor tuhne při -220 ° C (-363 ° F)[4] do krychlový struktura nazývaná beta-fluor. Tento fáze je transparentní a měkký, s významnou poruchou molekul; jeho hustota je 1,70 g / cm3. Při -228 ° C (-378 ° F) prochází fluor pevnou látkou fázový přechod do monoklinický struktura zvaná alfa-fluor. Tato fáze je neprůhledná a tvrdá, s těsně zabalenými vrstvami molekul a je hustší při 1,97 g / cm3.[5] Změna fáze v pevné fázi vyžaduje více energie než přechod bodu tání a může být prudká, rozbití vzorků a vyfouknutí oken držáku vzorků.[6][7]
Pevný fluor získal významnou studii ve 20. a 30. letech, ale relativně méně až do 60. let. Krystalová struktura daného alfa-fluoru, která má stále určitou nejistotu, pochází z roku 1970 Linus Pauling.
 |  |
| Nízkoteplotní fáze fluoru | Struktura alfa-fluoru |
Poznámky
- ^ Hustota vzduchu při 100kilopascal a 0 ° C je 1,2724 g / l.[2]
Citace
- ^ Jaccaud a kol. 2005, str. 2.
- ^ Shelquist, Richard (2010). „Úvod do výpočtů hustoty vzduchu a nadmořské výšky“. Shelquist Engineering. Citováno 29. dubna 2011.
- ^ Burdon, J .; Emson, B .; Edwards, A. J. (1987). „Je plynný fluor skutečně žlutý?“. Journal of Fluorine Chemistry. 34 (3–4): 471. doi:10.1016 / S0022-1139 (00) 85188-X.
- ^ A b Děkan 1999, str. 523.
- ^ http://jcp.aip.org/resource/1/jcpsa6/v49/i4/p1902_s1
- ^ Young, David A. (1975). Fázové diagramy prvků (Zpráva). Springer. str. 10. Citováno 2016-02-25.
- ^ Barrett, C. S .; Meyer, L .; Wasserman, J. (1967). „Argon - fázový diagram fluoru“. The Journal of Chemical Physics. 47 (2): 740–743. Bibcode:1967JChPh..47..740B. doi:10.1063/1.1711946.
Indexované odkazy
- Dean, John A. (1999). Langeho příručka chemie (15. vydání). McGraw-Hill, Inc. ISBN 0-07-016190-9.CS1 maint: ref = harv (odkaz)
- Ullmann, Franz, ed. (2005). Encyclopedia of Industrial Chemistry. Wiley-VCH. ISBN 978-3-527-30673-2.
- Jaccaud, Michael; Faron, Robert; Devilliers, Didier; Romano, René (2000). „Fluor“. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a11_293. ISBN 3527306730.
Další čtení
- Jordan, T. H .; Streib, W. E .; Lipscomb, W. N. (1964). "Rentgenová difrakční studie monokrystalického β-fluoru". The Journal of Chemical Physics. 41 (3): 760. Bibcode:1964JChPh..41..760J. doi:10.1063/1.1725957.
- Jordan, T. H .; Streib, W. D .; Smith, H. W .; Lipscomb, W. N. (1964). "Monokrystalické studie β-F2 a γ-O2". Acta Crystallographica. 17 (6): 777. doi:10.1107 / S0365110X6400202X.
- Meyer, L. (1968). "Krystalová struktura α-fluoru". The Journal of Chemical Physics. 49 (4): 1902–1907. Bibcode:1968JChPh..49.1902M. doi:10.1063/1.1670323.
- Pauling, L .; Keaveny, I .; Robinson, A. B. (1970). „Krystalová struktura α-fluoru“. Journal of Solid State Chemistry. 2 (2): 225–227. Bibcode:1970JSSCh ... 2..225P. doi:10.1016/0022-4596(70)90074-5.
- Etters, R. D .; Kirin, D. (1986). "Vysokotlaké chování pevného molekulárního fluoru při nízkých teplotách". The Journal of Physical Chemistry. 90 (19): 4670. doi:10.1021 / j100410a041.
- Kobashi, K .; Klein, M. L. (1980). "Mřížkové vibrace pevného α-F2". Molekulární fyzika. 41 (3): 679. Bibcode:1980MolPh..41..679K. doi:10.1080/00268978000103071.
- Angličtina, C. A .; Venables, J. A. (1974). "Struktura dvouiatomových molekulárních pevných látek". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 340 (1620): 57. Bibcode:1974RSPSA.340 ... 57E. doi:10.1098 / rspa.1974.0140.
- http://www.osti.gov/bridge/servlets/purl/4010212-0BbwUC/4010212.pdf (fázové diagramy prvků)
- http://jcp.aip.org/resource/1/jcpsa6/v47/i2/p740_s1?isAuthorized=no (prasknutí držáku vzorku)
- NASA ADS: Solid Fluorine and Solid Chlor: Crystal Structures and Intermolecular Forces od S. C. Nyburga
