Blízké infračervené okno v biologické tkáni - Near-infrared window in biological tissue
The blízké infračervené (NIR) okno (také známý jako optické okno nebo terapeutické okno) definuje rozsah vlnové délky od 650 do 1350 nanometrů (nm), kde světlo má maximální hloubku průniku v tkáň.[1] V okně NIR je rozptyl nejdominantnější interakcí světlo-tkáň, a proto se šířící světlo rychle rozptýlí. Protože rozptyl zvyšuje ujetou vzdálenost fotony v tkáni se také zvyšuje pravděpodobnost absorpce fotonů. Protože rozptyl má slabou závislost na vlnové délce, je okno NIR primárně omezeno absorpcí světla krví na krátkých vlnových délkách a vodou na dlouhých vlnových délkách. Technika používající toto okno se nazývá NIRS. Lékařské zobrazovací techniky, jako je chirurgie s fluorescenčním obrazem často využívají okno NIR k detekci hlubokých struktur.
Absorpční vlastnosti tkáňových složek
Absorpce součinitel () je definována jako pravděpodobnost absorpce fotonů ve tkáni na jednotku délky dráhy.[2] Různé tkáňové komponenty se liší hodnoty. Navíc, je funkce vlnové délky. Níže jsou diskutovány absorpční vlastnosti nejdůležitějších chromofory v tkáni. The molární extinkční koeficient () je další parametr, který se používá k popisu absorpce fotonů ve tkáni. Násobením pomocí molární koncentrace a pomocí ln (10) lze konvertovat na .

Krev
Krev se skládá ze dvou různých typů hemoglobin: oxyhemoglobin () je vázán na kyslík, zatímco deoxyhemoglobin () je nevázaný na kyslík. Tyto dva různé typy hemoglobinu vykazují odlišnou absorpci spektra které jsou obvykle zastoupeny ve smyslu molárních extinkčních koeficientů, jak je znázorněno na obrázku 1. Molární extinkční koeficient Hb má nejvyšší absorpční vrchol při 420 nm a druhý vrchol při 580 nm. Jeho spektrum se pak postupně snižuje s rostoucí vlnovou délkou světla. Na druhou stranu, ukazuje svůj nejvyšší absorpční pík při 410 nm a dva sekundární píky při 550 nm a 600 nm. Jak světelné vlnové délky prochází 600 nm, absorpce klesá mnohem rychleji než absorpce Hb. Body, kde spektra molárního extinkčního koeficientu a protínají se isosbestic body.
Použitím dvou různých vlnových délek je možné vypočítat koncentrace oxyhemoglobinu () a deoxyhemoglobin (), jak je znázorněno v následujících rovnicích:

Tady, a jsou dvě vlnové délky; a jsou molární extinkční koeficienty a , v uvedeném pořadí; a jsou molární koncentrace a nasycení kyslíkem () pak lze vypočítat jako
Voda
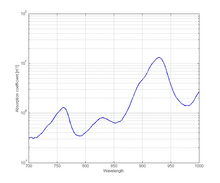
I když je voda v rozsahu viditelného světla téměř průhledná, absorbuje se v blízké infračervené oblasti. Voda je kritickou složkou, protože její koncentrace je vysoká v lidské tkáni. Absorpční spektrum vody v rozmezí od 250 do 1 000 nm je znázorněno na obrázku 2. Ačkoli je absorpce v tomto spektrálním rozmezí poměrně nízká, stále přispívá k celkovému útlumu tkáně.

Dalšími tkáňovými složkami s méně významným podílem na celkovém absorpčním spektru tkáně jsou melanin a tuky.
Melanin
Melanin je chromofor, který existuje v lidské epidermální vrstvě kůže a je odpovědný za ochranu před škodlivým UV zářením. Když jsou melanocyty stimulovány slunečním zářením, vzniká melanin.[7] Melanin je jedním z hlavních absorbérů světla v některých biologických tkáních (i když jeho příspěvek je menší než u jiných složek). Existují dva typy melaninu: eumelanin, který je černohnědý a feomelanin, který je červeno-žlutý.[8] Spektra koeficientu molárního extinkce odpovídající oběma typům jsou uvedena na obrázku 3.
Tlustý
Tuk je jednou z hlavních složek tkáně, která může obsahovat 10–40% tkáně. Ačkoli není k dispozici mnoho spekter tukového spektra savců, obrázek 4 ukazuje příklad extrahovaný z vepřového tuku.[9]

Rozptylové vlastnosti tkáňových složek
K optickému rozptylu dochází v důsledku nesouladu indexu lomu různých složek tkáně, od buněčných membrán po celé buňky. Jádra buněk a mitochondrie jsou nejdůležitější rozptylovače.[11] Jejich rozměry se pohybují od 100 nm do 6 μm, a spadají tedy do okna NIR. Většina z těchto organel spadá do Mie režim a vykazují vysoce anizotropní dopředný rozptyl.[12]
Rozptyl světla v biologické tkáni je označen koeficientem rozptylu (), která je definována jako pravděpodobnost rozptylu fotonů v tkáni na jednotku délky dráhy.[13] Obrázek 5 ukazuje graf rozptylového spektra.[14]
Efektivní koeficient útlumu
Útlum světla v hluboké biologické tkáni závisí na účinném koeficientu útlumu (), který je definován jako
kde je koeficient rozptylu přenosu definovaný jako
kde je anizotropie biologické tkáně, která má reprezentativní hodnotu 0,9. Obrázek 5 ukazuje graf spektra koeficientu rozptylu transportu v prsní tkáni, který má závislost na vlnové délce .[15] Efektivní koeficient útlumu je dominantním faktorem pro stanovení útlumu světla v hloubce ≫ 1/ .
Odhad okna NIR v tkáni
Okno NIR lze vypočítat na základě spektra absorpčního koeficientu nebo spektra účinného útlumu. Možné kritérium pro výběr okna NIR je dáno FWHM inverze těchto spekter, jak je znázorněno na obrázku 7.
Kromě celkové koncentrace hemoglobinu bude saturace kyslíkem definovat koncentraci kyslíku a deoxyhemoglobinu ve tkáni, a tím i celkové absorpční spektrum. V závislosti na typu tkáně můžeme uvažovat o různých situacích. Níže se předpokládá celková koncentrace hemoglobinu 2,3 mM.

Absorpční koeficient: λmin = 686 nm; Okno NIR = (634 - 756) nm.
Efektivní koeficient útlumu: λmin = 690 nm; Okno NIR = (618 - 926) nm.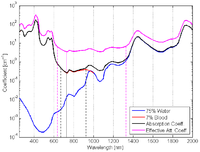
Absorpční koeficient: λmin = 730 nm; Okno NIR = (664 - 932) nm.
Efektivní koeficient útlumu: λmin = 730 nm; Okno NIR = (630 - 1328) nm.
Absorpční koeficient: λmin = 730 nm; Okno NIR = (656 - 916) nm.
Efektivní koeficient útlumu: λmin = 730 nm; Okno NIR = (626 - 1316) nm.Absorpční spektrum pro tepny
V tomto případě ≈ 98% (arteriální nasycení kyslíkem). Pak bude oxyhemoglobin dominovat ve spektrech celkové absorpce (černá) a efektivního útlumu (purpurová), jak je znázorněno na obrázku 6 (a).
Absorpční spektrum pro žíly
V tomto případě ≈ 60% (venózní nasycení kyslíkem). Pak budou mít oxyhemoglobin a deoxyhemoglobin podobné příspěvky na spektra koeficientů celkové absorpce (černá) a efektivního útlumu (purpurová), jak je znázorněno na obrázku 6 (b).

Absorpční spektrum pro prsní tkáň
Definovat (nasycení tkáně kyslíkem) (nebo (index nasycení tkáně)), je nutné definovat distribuci tepen a žil ve tkáni. lze použít poměr objemu arteriální venózní krve 20% / 80%.[16] Tedy nasycení tkáně kyslíkem lze definovat jako = 0,2 x + 0,8 x ≈ 70%.
Spektra celkové absorpce (černá) a efektivního útlumu (purpurová) pro prsní tkáň jsou znázorněna na obrázku 6 (c). Efektivní hloubka penetrace je navíc zakreslena na obrázku 7.
Viz také
Reference
- ^ Smith, Andrew M .; Mancini, Michael C .; Nie, Shuming (2009). „Bioimaging: Second window for in vivo imaging“. Přírodní nanotechnologie. 4 (11): 710–711. doi:10.1038 / nnano.2009.326. ISSN 1748-3387. PMC 2862008. PMID 19898521.
- ^ LV. Wang a HI. Wu, biomedicínská optika. Wiley. ISBN 978-0-471-74304-0, 2007.
- ^ Molární extinkční koeficienty kyslíku a deoxyhemoglobinu sestavené Scottem Prahlem. URL: http://omlc.ogi.edu/spectra/hemoglobin.
- ^ G. M. Hale a M. R. Querry, Optické konstanty vody v oblasti vlnové délky 200 nm až 200 um, Appl. Opt., 12, 555-563, 1973.
- ^ Koeficient extinkce melaninu od Stevena Jacquesa. URL: http://omlc.ogi.edu/spectra/melanin/extcoeff.html.
- ^ R.L.P. van Veen, H.J.C.M. Sterenborg, A. Pifferi, A. Torricelli a R. Cubeddu, výroční tematické setkání OSA BIOMED, 2004.
- ^ T. Vo-Dinh, Biomedical Photonics Handbook. Taylor & Francis, Inc. ISBN 0-8493-1116-0, 2002.
- ^ George Zonios a Aikaterini Dimou, Ioannis Bassukas, Dimitrios Galaris a Argyrios Ysolakidis a Efthimios Kaxiras, J. Biomed. Opt., Sv. 13, 014017, 2008.
- ^ R.L.P. van Veen, H.J.C.M. Sterenborg, A. Pifferi, A. Torricelli a R. Cubeddu, výroční tematické setkání OSA BIOMED, 2004.
- ^ S. Jacques, C. Newman, D. Levy a A. von Eschenbach. Univ. of Texas M. D. Anderson Cancer Center, 1987.
- ^ LV. Wang a HI. Wu, biomedicínská optika. Wiley. ISBN 978-0-471-74304-0, 2007.
- ^ T. Vo-Dinh, Biomedical Photonics Handbook. Taylor & Francis, Inc. ISBN 0-8493-1116-0, 2002.
- ^ LV. Wang a HI. Wu, biomedicínská optika. Wiley. ISBN 978-0-471-74304-0, 2007.
- ^ S. Jacques, C. Newman, D. Levy a A. von Eschenbach. Univ. of Texas M. D. Anderson Cancer Center, 1987.
- ^ S. Srinivasan, B. Pogue, S. Jiang, H. Dehghani, C. Kogel, S. Soho, J. Gibson, T. Tosteson, S. Poplack a K. Paulsen, K D 2003, Proc Natl Acad. Sci. USA 100 12349 54.
- ^ S. Nioka, S. Wen, J. Zhang, J. Du, X. Intes, Z. Zhao a B. Chance, Simulační studie hemodynamiky prsní tkáně během perturbace tlaku. Transport kyslíku do tkáně XXVI 566, 17-22, 2006.





























