Glasdegib - Glasdegib - Wikipedia
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Daurismo |
| Ostatní jména | PF-04449913 |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a619004 |
| Těhotenství kategorie |
|
| ATC kód | |
| Právní status | |
| Právní status | |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Informační karta ECHA | 100.244.738 |
| Chemické a fyzikální údaje | |
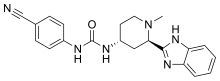
| Vzorec | C21H22N6Ó |
| Molární hmotnost | 374.448 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
Glasdegib, prodávané pod značkou Daurismo, je lék na léčbu nově diagnostikované akutní myeloidní leukémie (AML) u dospělých starších 75 let nebo u těch, kteří mají komorbiditu, která vylučuje použití intenzivní indukční chemoterapie.[3][4] Užívá se ústy a používá se v kombinaci s nízkou dávkou cytarabin.[4]
Doporučená dávka glasdegibu je 100 mg perorálně jednou denně 1. až 28. den v kombinaci s cytarabinem 20 mg subkutánně dvakrát denně 1. až 10. den každého 28denního cyklu, pokud nedojde k nepřijatelné toxicitě nebo ztrátě kontroly onemocnění.[4]
Nejběžnějšími nežádoucími účinky jsou anémie, únava, krvácení, febrilní neutropenie, muskuloskeletální bolest, nevolnost, otoky, trombocytopenie, dušnost, snížená chuť k jídlu, dysgeuzie, mukozitida, zácpa a vyrážka.[3]
Je to malý molekulový inhibitor zvukový ježek, což je nadměrně exprimovaný protein u mnoha typů rakoviny. Inhibuje receptor sonického ježka uhlazen (SMO), stejně jako většina léků ve své třídě.[5]
Dějiny
Glasdegib byl schválen pro lékařské použití ve Spojených státech v prosinci 2018.[3][4][6][7]
Schválení FDA bylo založeno na multicentrické, otevřené, randomizované studii (BRIGHT AML 1003, NCT01546038), která zahrnovala 115 subjektů s nově diagnostikovanou AML, kteří splňovali alespoň jedno z následujících kritérií: a) věk 75 let nebo starší, b) závažné srdeční onemocnění, c) výchozí stav výkonnosti skupiny Eastern Cooperative Oncology Group 2, nebo d) výchozí sérový kreatinin> 1,3 mg / dL.[3] Subjekty byly randomizovány v poměru 2: 1 k podávání glasdegibu 100 mg denně s LDAC 20 mg subkutánně dvakrát denně ve dnech 1 až 10 28denního cyklu (N = 77) nebo samotného LDAC (N = 38) ve 28denních cyklech až do progrese onemocnění nebo nepřijatelné toxicity.[3] Soud byl veden ve Spojených státech, Kanadě a Evropě.[8]
Účinnost byla stanovena na základě zlepšení celkového přežití (datum randomizace k úmrtí z jakékoli příčiny).[3] Při mediánu sledování 20 měsíců byl medián přežití 8,3 měsíce (95% CI: 4,4; 12,2) v rameni glasdegib + LDAC a 4,3 měsíce (95% CI: 1,9; 5,7) v rameni samotném LDAC a HR 0,46 (95% CI: 0,30; 0,71; p = 0,0002).[3]
Glasdegib byl udělen prioritní kontrola a lék na vzácná onemocnění označení USA Úřad pro kontrolu potravin a léčiv (FDA).[3][9] Bylo to uděleno lék na vzácná onemocnění označení podle Evropská agentura pro léčivé přípravky (EMA) v říjnu 2017.[10]
Glasdegib byl schválen pro lékařské použití v Evropské unii v červnu 2020.[2]
Reference
- ^ „Použití Glasdegibu (Daurismo) během těhotenství“. Drugs.com. 14. prosince 2018. Citováno 25. března 2020.
- ^ A b „Daurismo EPAR“. Evropská agentura pro léčivé přípravky (EMA). 28. dubna 2020. Citováno 25. září 2020.
- ^ A b C d E F G h „FDA schvaluje glasdegib pro AML u dospělých ve věku 75 let nebo starších nebo u pacientů s komorbiditou“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA) (Tisková zpráva). 21. listopadu 2018. Citováno 25. března 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ A b C d „Tableta Daurismo-glasdegib potažená filmem“. DailyMed. 26. listopadu 2019. Citováno 25. března 2020.
- ^ „Glasdegib - AdisInsight“. Adisinsight.springer.com. Citováno 2017-05-22.
- ^ „Balíček pro schválení léků: Daurismo (glasdegib)“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 17. prosince 2018. Citováno 25. března 2020.
- ^ „Daurismo: drogy schválené FDA“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 25. března 2020.
- ^ „Snapshot s drogami: Daurismo“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 21. listopadu 2018. Citováno 25. března 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ „Hledat označení a schválení léčivých přípravků pro vzácná onemocnění“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 24. prosince 1999. Citováno 25. března 2020.
- ^ „EU / 3/17/1923“. Evropská agentura pro léčivé přípravky (EMA). 17. září 2018. Citováno 25. března 2020.
externí odkazy
- "Glasdegib". Informační portál o drogách. Americká národní lékařská knihovna.
- Číslo klinického hodnocení NCT01546038 pro „Studie hodnotící PF-04449913 s chemoterapií u pacientů s akutní myeloidní leukémií nebo myelodysplastickým syndromem“ na ClinicalTrials.gov
| Tento antineoplastický nebo imunomodulační lék článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
