Fluorace tetrafluoridem sírovým - Fluorination by sulfur tetrafluoride
Fluorace tetrafluoridem sírovým vyrábí organofluorové sloučeniny z oxidovaných organických sloučenin, včetně alkoholů, karbonylových sloučenin, alkylhalogenidů a dalších.[1]
Tetrafluorid síry je plynné činidlo, které lze použít k fluoraci různých organických funkčních skupin, včetně karbonylových sloučenin, alkoholů a halogenidů. Zpracování karbonylových sloučenin je obecně převádí na organofluoridy ekvivalentního oxidačního stavu: karboxylové kyseliny se převádějí na trifluormethylové sloučeniny, ketony a aldehydy na difluoridy atd. Reakce má široký rozsah a je jednou z mála dostupných metod pro přímé zavedení fluoru na konkrétní místo za relativně mírných podmínek.
(1)

U SF jsou také možné fluorace alkoholů a halogenidů4. Nicméně, SF4 je při pokojové teplotě plynný a mnoho transformací zahrnujících toto činidlo vyžaduje zvýšené teploty, což poněkud ztěžuje manipulaci. Kromě toho reakce generuje velké množství fluorovodík. Tyto obavy vedly k vývoji bezpečnějších a robustnějších fluoračních činidel, jako je DAST (diethylaminosulfur trifluorid ).[2]
Mechanismus a stereochemie
Převládající mechanismus
Mechanismus fluorace SF4 je nejistá a liší se mezi substráty. Původně byly jako meziprodukty navrženy alkoxysulfur trifluoridy;[3] avšak reakce izolovaných alkoxysulfur trifluoridů s fluorovodík nebo zahřívání neposkytly odpovídající alkylfluoridy.
(2)

Mechanismus difluorace vicinálních diolů byl dobře zaveden,[4] a postupuje invertivním útokem na jednu hydroxylovou skupinu za vzniku fluorosulfitového meziproduktu, který se po dalším zpracování SF převede na difluorovaný produkt4 a HF. Druhá fluorace probíhá se zachováním konfigurace. Zde je možné intramolekulární dodávání fluoridu a bylo pozorováno v některých dalších případech fluorace SF4. SNMechanismy 1 fungují pro sloučeniny, které snadno tvoří karbokationty, zatímco SN2 reakce probíhají s méně ionizovatelnými sloučeninami.
(3)

Fluorace karboxylových kyselin poskytuje nejen očekávané trifluormethylové sloučeniny, ale také a-tetrafluorované ethery. Byl navržen a experimentálně podporován mechanismus zohlednění obou produktů.[5] Bylo vysvětleno intramolekulární dodávání fluoridu, aby se vysvětlila tvorba difluormethylových kationtů. Útok molekuly acylfluoridu na difluormethyl kation, následovaný neutralizací pomocí in situ generovaný bifluorid vede k a-tetrafluorovaným etherovým produktům. Přímou reakcí s bifluoridem se získají produkty obsahující trifluormethyl.
(4)

Rozsah a omezení
Sírový tetrafluorid lze použít k nahrazení různých funkčních skupin částečně nebo plně fluorovanými deriváty. Kapalný fluorovodík lze použít jako rozpouštědlo a katalyzátor se SF4 selektivně fluorovat alkoholy.[6] SF4Reaktivita s karbonylovými sloučeninami není v přítomnosti HF zvýšena. Obecně lze s SF účinně fluorovat pouze relativně kyselé alkoholy4, ačkoli aminoalkoholy se zdají být výjimkou z tohoto pravidla.
(5)
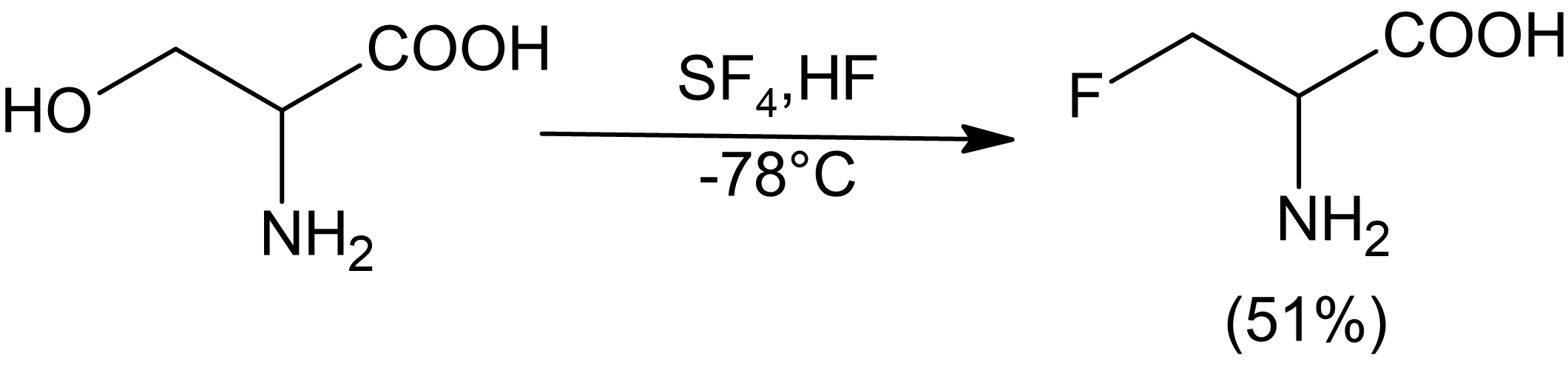
Když jsou vicinální dioly kombinovány se SF4, dochází k difluoraci s inverzí konfigurace u jednoho z alkoholů. To bylo prokázáno při syntéze mezo-difluorosukcinát z (L) -tartrátu a syntéza (D) - a (L) -difluorosukcinátu mezo- vínan[7]
(6)

Karbonylové sloučeniny obecně reagují se SF4 za získání geminálních difluoridů. Reakční doby bývají řádově hodiny a výtěžky jsou mírné.[8]
(7)
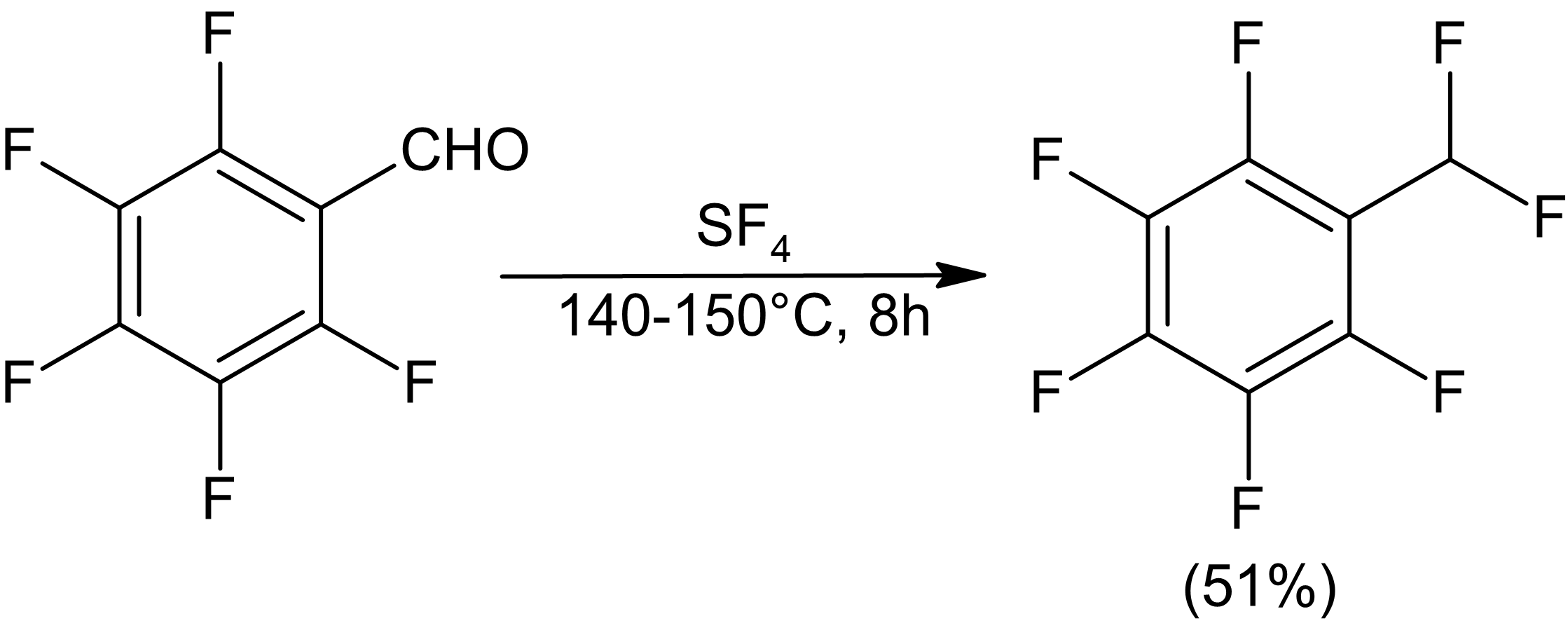
Fluorace laktonů může poskytnout heterocyklické fluoridy, i když u y-butyrolaktonu bylo pozorováno otevření kruhu. Šestičlenný laktid nezažije otevření kruhu.[9]
(8)

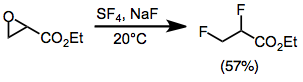
Fluorace otevírá epoxidy a ve většině případů poskytuje geminální nebo vicinální difluoridy. Monoarylepoxidy poskytují geminální produkty s migrací arylové skupiny. Výtěžky jsou nízké u stericky bráněných di- a trisubstituovaných epoxidů. Epoxidy substituované esterovou skupinou poskytují vicinální difluoridy prostřednictvím meziproduktu alkoxysulfur trifluoridu.[10]
(9)
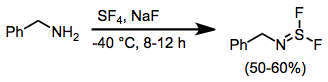
Pokud jsou aminy ošetřeny SF4 a výsledkem je báze, iminosulfur difluoridy. Další reakce těchto sloučenin s fluoridy alkalických kovů vede k nitrilové sulfidy, které procházejí [3 + 2] cykloadicí v přítomnosti dipolarofilů.[11]
(10)
Karboxylové kyseliny reagují se SF4 za získání trifluormethylových sloučenin prostřednictvím acylfluoridu. Tetrafluoralkylethery také vznikají reakcí mezi difluormethyl kationtem a acylfluoridem.[12]
(11)

Pro efektivní fluorování polymerů lze použít tetrafluorid síry. To má často zásadní vliv na vlastnosti polymeru - například fluorace polyvinylalkoholu zlepšuje jeho odolnost vůči silným kyselinám a zásadám.[13]
Syntetické aplikace
Syntéza prostaglandinu nesoucího trifluormethylovou skupinu na C-16 je založena na meziproduktu získaném fluorací karboxylové kyseliny tetrafluoridem sírovým.[14]
(12)

Srovnání s jinými metodami
Moderní metody fluorace učinily fluorid sírový v podstatě zastaralým. Použití snáze manipulovatelného činidla DAST (diethylaminosulfur trifluorid ) je nyní upřednostňován před SF4 pro nukleofilní fluorační reakce. DAST je selektivnější při fluoraci alkoholů a podporuje méně přeskupení a eliminaci v kyselých substrátech. Nepříjemnost při manipulaci s plynným SF4 je nevýhodou fluorací využívajících toto činidlo. Navíc, pokud je použit HF, nemůže být v substrátu přítomna funkce labilní vůči kyselinám. Elektrofilní fluorační činidla, jako např Selectfluor a N-fluorosulfonimidy, doplňují reaktivitu SF4 a vyhnout se těmto problémům.[15]
(13)

Experimentální podmínky a postup
Typické podmínky
Tetrafluorid síry je bezbarvý plyn při pokojové teplotě, i když se vaří při -38 ° C. Je rychle hydrolyzován ve vodném prostředí a je korozivní a toxický; reakce by tedy měly být prováděny v dobře větraném digestoři s rukavicemi a brýlemi. Tetrafluorid síry nereaguje s nerezovou ocelí, mědí nebo niklem. Obvykle jsou fluorační reakce s SF4 se provádějí v třepačce z nerezové oceli. Plynná činidla se zavádějí do třepačky kondenzací a plynné produkty se obvykle odvětrávají, když je reakce dokončena (pokud plynné produkty nejsou zajímavé, v takovém případě mohou být kondenzovány do samostatné nádoby). Fluorovodík lze oddělit od požadovaných produktů nalitím reakční směsi do vody a následnou filtrací. V této souvislosti lze také použít roztoky hydroxidu vápenatého, čímž se získá neškodný roztok fluorid vápenatý.
Příklad postupu[16]
(14)

5-Hydroxyhistamin dihydrochlorid (1700 mg, 3,5 mmol) byl rozpuštěn ve 25 ml bezvodé kapalné HF a roztok byl odpařen v proudu suchého dusíku, aby se odstranila HC1. Zbytek byl znovu rozpuštěn ve 40 ml HF při -78 ° C, zpracován 2,3 ml SF4 (40,3 mmol) a zahřívá se 2,5 hodiny na 0 ° C. Po opětovném ochlazení na -78 ° C se přidají další 2 ml SF4 byl kondenzován do roztoku. Reaktor se poté ponoří do ledové lázně (přibližně 1 1), která se nechá přes noc ohřát na teplotu místnosti. HF se poté odstraní v proudu N2, zbytek byl rozpuštěn v 25 ml 2,5 N HC1 a roztok byl zahuštěn ve vakuu na gumovitý zbytek. Ten byl nanesen na 150 ml Dowexu 50X8 a eluován 200 ml H2O, 400 ml 1 N HC1 a ca. 1 l 2,5 N HC1. Frakce pozitivní na ninhydrin (2,5 N HC1) byly zahuštěny na 500 mg krystalického B-fluorohistamin dihydrochloridu (71%): rozklad při 130 ° C, pokud byl vložen při této teplotě; 60-MHz 11H NMR (D2O-DCl) 5 3,3-4,2 (široký multiplet, 2 H), 6,27 (dublet čtyřřádkových multipletů, 1 H, JHF = 47 Hz), 7,83 (m, 1H, JHF = 2 Hz), 9,0 (s, 1 H). Anální. Calc'd. pro C.5H10N3FCl2C: 29,70; H, 4,95; N, 20,80; F, 9,40. Nalezeno: C, 29,69; H, 4,94; N, 20,51; F, 9,72.
Reference
- ^ Wang, C.-L. J. Org. Reagovat. 1985, 34, 319. doi:10.1002 / 0471264180.nebo034.02
- ^ Hudlicky, M. Org. Reagovat. 1988, 35, 513.
- ^ Hašek, R .; Smith, C .; Engelhardt, A. J. Am. Chem. Soc. 1960, 82, 543.
- ^ Burmakov, I .; Motnyak, A .; Kunshenako, V .; Alexseeva, A .; Yagupol'skii, M. J. Fluorine Chem. 1981, 19, 151.
- ^ Dmowski, W .; Kolinski, A. Pol. J. Chem. 1978, 52, 547.
- ^ Kollonitsch, J .; Marburg, S .; Perkins, M. J. Org. Chem. 1975, 40, 3808.
- ^ Bell, M .; Hudlicky, M. J. Fluorine Chem. 1980, 15, 191.
- ^ Mobbs, H. J. Fluorine Chem. 1971, 1, 361.
- ^ Muratov, N .; Burmakov, I .; Kunshenko, V .; Alekseeva, A .; Yagupol'skii, M. J. Org. Chem. SSSR (angl. Překlad) 1982, 18, 1220.
- ^ Yagupol'skii, M .; Golikov, I .; Alekseeva, A .; Aleksandrov, M. J. Org. Chem. SSSR (angl. Překlad) 1971, 7, 737.
- ^ Grunwell, R .; Dye, L. Tetrahedron Lett., 1975, 1739.
- ^ Dmowski, W .; Kolinski, A. Rocz. Chem. 1974, 48, 1697.
- ^ Bezsolitsen, P .; Gorbunov, N .; Nazarov, A .; Khardin, P. Vysokomol. Soedin, ser. A 1972, 14950 [C.A., 77, 75710e (1972)].
- ^ Holland, G. W .; Jernow, J. L .; Rosen, P. U.S. 4,256,911 (1981) [C.A., 89, 14 6500 x (1978)].
- ^ Badoux, J .; Cahard, D. Org. Reagovat. 2007, 69, 347.
- ^ Burmakov, I .; Motnyak, A .; Kunshenko, V .; Alekseeva, A .; Yagupol'skii, M. J. Org. Chem. SSSR (angl. Překlad) 1980, 16, 1204.
