Divisome - Divisome
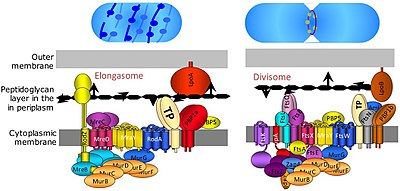
The dělící je proteinový komplex v bakterie za který je zodpovědný buněčné dělení zúžení vnitřní a vnější membrány během dělení a peptidoglykan (PG) syntéza v místě dělení. Divisom je komplex membránových proteinů s proteiny na obou stranách cytoplazmatické membrány. v gramnegativní buňky nachází se ve vnitřní membráně. Divisome je v bakteriích téměř všudypřítomný, i když se jeho složení může u jednotlivých druhů lišit.[2]
The elongasome je upravená verze divisomu bez omezení membrány FtsZ -ring a související strojní zařízení. Elongasome je přítomen pouze v nesférických bakteriích a řídí laterální inzerci PG podél dlouhé osy buňky, což umožňuje válcovitý růst (na rozdíl od sférického růstu, jako u koky ).[2]
Dějiny
Některé z prvních genů buněčného dělení Escherichia coli byly objeveny uživatelem François Jacob skupina ve Francii v 60. letech. Byli povoláni fts geny, protože mutanty těchto genů udělily a Filamentous temperature-sfenotyp.[3] Při nepřípustné teplotě (obvykle 42 ° C) se mutantní buňky fts nadále prodlužují bez dělení a vytvářejí vlákna, která mohou mít až 150 m dlouhý (na rozdíl od 2-3 mv buňkách divokého typu). S objevem genu ftsZ v roce 1980 došlo ke třem průlomům[4] a uvědomění, že FtsZ protein byl lokalizován do dělicí roviny dělících se buněk,[5] a konečně zjištění, že struktura FtsZ je pozoruhodně podobná tubulin a že pravděpodobně mají společného předka.[6]
Složení
Přesné složení divisomu a elongasomu zůstává neznámé, jelikož se jedná o vysoce dynamické proteinové komplexy, které během dělení buněk přijímají a uvolňují určité proteiny. Je však známo, že více než 20 proteinů je součástí divisomu v E-coli s podobným počtem proteinů v Grampozitivní bakterie (jako Bacillus subtilis ), i když ne všechny proteiny jsou konzervovány bakteriemi.[7]
Bylo zjištěno, že několik dalších genů fts, jako jsou ftsA, ftsW, ftsQ, ftsI, ftsL, ftsK, ftsN a ftsB, je nezbytných pro buněčné dělení a pro asociaci s divisomovým komplexem a prstenem FtsZ. Protein FtsA se váže přímo na FtsZ v cytoplazmě a FtsB, FtsL a FtsQ tvoří esenciální membránový subkomplex. FtsK a FtsW jsou větší proteiny s více transmembránovými doménami. FtsI, také známý jako PBP3, je divisome-specifická transpeptidáza potřebná pro syntézu dělícího septa.
Replikace DNA a dělení buněk
Replikace DNA v bakteriích je úzce spojena s buněčným dělením. Například blokování replikace v B. subtilis vede k prodlouženým buňkám bez správného buněčného dělení. Replikace bakteriální DNA je iniciována vazbou DnaA (ATPázy) na počátek replikace (oriC) ve střední buňce. Sestava FtsZ je spojena s úspěšnou replikací DNA[7] s MatP a ZapB nějakým způsobem koordinují interakce mezi dělícím aparátem a replikací DNA během segregace chromozomů E-coli.[8]
Shromáždění divisomu
Přesný proces montáže divisomu není dobře znám. Začíná to časnými proteiny FtsZ a jeho membránovou kotvou FtsA a proteiny ZipA, EzrA a Zaps (ZapA, ZapB, ZapC, ZapD), které podporují tvorbu kruhu FtsZ. Zatímco FtsA a FtsZ jsou mezi bakteriemi vysoce konzervované, proteiny ZipA, EzrA a Zap jsou méně dobře konzervované a u některých druhů chybí.[7] Za časné proteiny je přidán subkomplex FtsQLB,[9] následovaný FtsI (transpeptidáza), FtsW (transglykosyláza) a FtsN. FtsI i FtsW jsou potřebné pro syntézu septální stěny.[10] FtsW souvisí s domnělou elongací specifickou transglykosylázou RodA, dalším děleným proteinem.[11] Zdá se, že FtsN má několik funkcí: stabilizuje divisom (alespoň při nadměrné expresi), působí jako spouštěč cytokineze (prostřednictvím interakcí s FtsI a FtsW) a aktivuje nábor FtsQLB zprostředkovaný FtsA.[12][13] I když jsou FtsA, FtsQLB, FtsI a FtsW široce konzervované, FtsN je omezen na gramnegativní organismy (jako např. E-coli) a proto není všeobecně vyžadován.[7]
Viz také
Reference
- ^ Hugonnet, Jean-Emmanuel; Mengin-Lecreulx, Dominique; Monton, Alejandro; Blaauwen, Tanneke den; Carbonnelle, Etienne; Veckerlé, Carole; Yves; Brun, V .; Nieuwenhze, Michael van (2016-10-21). „Faktory nezbytné pro zesíťování peptidoglykanů zprostředkované L, D-transpeptidázou a rezistenci β-laktamu u Escherichia coli“. eLife. 5. doi:10,7554 / elife.19469. ISSN 2050-084X. PMC 5089857. PMID 27767957.
- ^ A b Szwedziak, Piotr; Löwe, leden (prosinec 2013). „Sdílí divisome a elongasome společnou evoluční minulost?“. Současný názor v mikrobiologii. 16 (6): 745–751. doi:10.1016 / j.mib.2013.09.003. ISSN 1879-0364. PMID 24094808.
- ^ Hirota, Y .; Ryter, A .; Jacob, F. (1968). "Termosenzitivní mutanti E. coli ovlivnění v procesech syntézy DNA a buněčného dělení". Cold Spring Harbor Symposia o kvantitativní biologii. 33: 677–693. doi:10,1101 / sqb.1968.033.01.077. ISSN 0091-7451. PMID 4892005.
- ^ Lutkenhaus, J. F .; Wolf-Watz, H .; Donachie, W. D. (květen 1980). „Organizace genů v oblasti ftsA-envA genetické mapy Escherichia coli a identifikace nového lokusu fts (ftsZ)“. Journal of Bacteriology. 142 (2): 615–620. doi:10.1128 / JB.142.2.615-620.1980. ISSN 0021-9193. PMC 294035. PMID 6991482.
- ^ Bi, E. F .; Lutkenhaus, J. (1991-11-14). "FtsZ kruhová struktura spojená s dělením v Escherichia coli". Příroda. 354 (6349): 161–164. doi:10.1038 / 354161a0. ISSN 0028-0836. PMID 1944597.
- ^ Löwe, J .; Amos, L. A. (01.01.1998). "Krystalová struktura bakteriálního proteinu buněčného dělení FtsZ". Příroda. 391 (6663): 203–206. doi:10.1038/34472. ISSN 0028-0836. PMID 9428770.
- ^ A b C d den Blaauwen, Tanneke; Hamoen, Leendert W; Levin, Petra Anne (01.04.2017). „Divisome at 25: the road ahead“. Současný názor v mikrobiologii. Regulace buněk. 36: 85–94. doi:10.1016 / j.mib.2017.01.007. ISSN 1369-5274. PMC 6436919. PMID 28254403.
- ^ Espéli, Olivier; Borne, Romain; Dupaigne, Pauline; Thiel, Axel; Gigant, Emmanuelle; Mercier, Romain; Boccard, Frédéric (2012-07-18). „Interakce MatP – divisom koordinuje segregaci chromozomů s buněčným dělením v E. coli“. Časopis EMBO. 31 (14): 3198–3211. doi:10.1038 / emboj.2012.128. ISSN 0261-4189. PMC 3400007. PMID 22580828.
- ^ Buddelmeijer, Nienke; Beckwith, Jon (červen 2004). "Komplex proteinů buněčného dělení Escherichia coli FtsL, FtsB a FtsQ se tvoří nezávisle na jeho lokalizaci do septální oblasti". Molekulární mikrobiologie. 52 (5): 1315–1327. doi:10.1111 / j.1365-2958.2004.04044.x. ISSN 0950-382X. PMID 15165235.
- ^ Wang, Lilin; Khattar, Medhat K .; Donachie, W. D .; Lutkenhaus, Joe (01.06.1998). „FtsI a FtsW jsou lokalizovány do septum in Escherichia coli“. Journal of Bacteriology. 180 (11): 2810–2816. doi:10.1128 / JB.180.11.2810-2816.1998. ISSN 1098-5530.
- ^ Meeske, Alexander J .; Riley, Eammon P .; Robins, William P .; Uehara, Tsuyoshi; Mekalanos, John J .; Kahne, Daniel; Walker, Suzanne; Kruse, Andrew C .; Bernhardt, Thomas G .; Rudner, David Z. (září 2016). „Proteiny SEDS jsou rozšířenou rodinou polymeráz bakteriálních buněčných stěn“. Příroda. 537 (7622): 634–638. doi:10.1038 / příroda19331. ISSN 1476-4687. PMC 5161649. PMID 27525505.
- ^ Dai, K; Xu, Y; Lutkenhaus, J (1993). „Klonování a charakterizace ftsN, esenciálního genu buněčného dělení v Escherichia coli izolovaného jako multikopický supresor ftsA12 (Ts)“. Journal of Bacteriology. 175 (12): 3790–3797. doi:10.1128 / JB.175.12.3790-3797.1993. ISSN 0021-9193. PMC 204796. PMID 8509333.
- ^ Pichoff, Sebastien; Du, Shishen; Lutkenhaus, Joe (2015). „Obtok ZipA nadměrnou expresí FtsN vyžaduje dříve neznámý konzervovaný motiv FtsN nezbytný pro interakci FtsA – FtsN podporující model, ve kterém monomery FtsA přijímají proteiny pozdního buněčného dělení do Z kruhu“. Molekulární mikrobiologie. 95 (6): 971–987. doi:10,1111 / mmi.12907. ISSN 1365-2958. PMC 4364298. PMID 25496259.

