Dependoparvovirus - Dependoparvovirus - Wikipedia
| Dependoparvovirus | |
|---|---|
 | |
| Klasifikace virů | |
| (bez hodnocení): | Virus |
| Oblast: | Monodnaviria |
| Království: | Shotokuvirae |
| Kmen: | Cossaviricota |
| Třída: | Quintoviricetes |
| Objednat: | Piccovirales |
| Rodina: | Parvoviridae |
| Podčeleď: | Parvovirinae |
| Rod: | Dependoparvovirus |
| Zadejte druh | |
| Závislý adaropovirus A související s adeno | |
Dependoparvovirus (dříve Dependovirus nebo Skupina virů spojená s adeno) je rod z podčeledi Parvovirinae z virus rodina Parvoviridae;[1][2] jsou to viry skupiny II podle Baltimore klasifikace. Některé dependoparvoviry jsou také známé jako adeno-asociované viry, protože nemohou replikovat produktivně v jejich hostitelská buňka aniž by byla buňka koinfikován podle a pomocný virus jako je adenovirus, a herpesvirus nebo virus vakcínie.
Druh
V současné době existuje deset uznávaných druhů:[3]
- Závislý adaropovirus A související s adeno, druh typu
- Závislý adaropovirus B související s adenem
- Anseriformní dependoparvovirus 1
- Ptačí závislost na viru 1
- Chiropteran dependoparvovirus 1
- Pinipiped dependoparvovirus 1
- Závislost hlodavců na hlodavcích 1
- Závislost na hlodavcích 2
- Squamate dependoparvovirus 1
- Squamate dependoparvovirus 2
Virologie
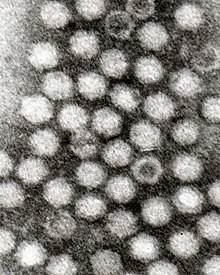
Dependoparvoviry mají icosahedral tvar, měří 22 nm[4] se skládá z 60 trojúhelníkových čísel bílkovin ve tvaru klínu = 1). V každé kapsomere jsou přítomny tři proteiny (VP1, VP2 a VP3). Každá kapsida je vyrobena z 5 VP1, 5 VP2 a 50 VP3 proteinů. Kapsida nemá obálku.[5]
Genom je jedna molekula jednovláknové DNA o délce 4,7 kilobází. Má pouze dva otevřené čtecí rámce. 3 'otevřený čtecí rámec je strukturní kapsidový protein, víčko, které lze spojit a vytvořit dvě RNA, jednu pro virionový protein 1 (VP1) a druhou, která nakonec vytvoří VP2 a VP3. Druhý gen, rep, může být sestříhán do čtyř různých nestrukturálních regulačních proteinů, které všechny pomáhají při replikaci genomu. Tyto proteiny jsou pojmenovány Rep 78, Rep68, Rep 52 a Rep 40 na základě jejich molekulové hmotnosti.[4]
Kvůli obráceným terminálním opakováním (ITR) na každém konci genomu, ve tvaru písmene T. sekundární struktura je vytvořen. Doplňkové oblasti ponechávají 3 ' hydroxyl seskupte jednopramenné, aby mohla začít replikace. Tato 3 'hydroxylová skupina se používá jako a primer pro přední vlákno syntéza. Vyrábí se pozitivní i negativní smyslové řetězce DNA. Během replikace se tvoří dvouvláknové meziprodukty; to znamená, že tyto dva směry, pozitivní a negativní, budou spojeny.[4][5]
Rozsah hostitelů
Tyto viry jsou schopné replikace u všech obratlovců. Omezuje je pouze virus, kterým musí infikovat, známý také jako pomocný virus. Tyto pomocné viry jsou nezbytné pro replikaci závislého parvoviru. Běžným pomocným virem u lidí je adenovirus.[Citace je zapotřebí ]
Genová terapie
Dependoparvovirus není dostatečně infekční, aby spustil imunitní odpověď; díky tomu je dobrý virus použit jako nástroj genové terapie. Genová terapie je možnou léčbou různých poruch a chorob, které jsou genetického původu. Virové vektory jsou v současné době vyvíjeny pro transport genů do lidských buněk. Protože tento virus nestimuluje imunitní odpověď, lze jej použít několikrát účinně, aniž by byl před infekcí neutralizován[Citace je zapotřebí ] . Dalším důvodem, proč jsou tyto viry spolehlivými vektory, je známý bod inzerce pro genom. Tento virus vždy vloží svůj obsah na stejné místo na 19. chromozomu.[Citace je zapotřebí ] Tato předvídatelnost může snížit pravděpodobnost vložení do důležité oblasti, která by mohla narušit normální funkci genu nebo zvýšit riziko vzniku rakoviny.[6]
V současné době je jednou z výzev použití tohoto viru jako terapeutického nástroje skutečnost, že genom je poměrně malý. S méně než 5 kB v genomu je množství genetického materiálu, který se vejde do kapsidy, omezené. V současné době se pracuje na zvýšení množství informací, které může tento vektor dodat. Toho lze dosáhnout pomocí ITR nalezených na 5 'i 3' konci genomu. Vzhledem k tomu, že ITR mají stejnou sekvenci, ponechají exponovaná doplňková vlákna, pokud jsou odstraněna. Doplňkové prameny mohou podstoupit rekombinace a spojte dva 5kb vložené fragmenty dohromady.[7]
Reference
- ^ Cotmore, SF; Agbandje-McKenna, M; Canuti, M; Chiorini, JA; Eis-Hubinger, A; Hughes, J; Mietzsch, M; Modha, S; Ogliastro, M; Pénzes, JJ; Pintel, DJ; Qiu, J; Soderlund-Venermo, M; Tattersall, P; Tijssen, P; a konsorcium zpráv ICTV (2019). „Profil taxonomie viru ICTV: Parvoviridae“. Journal of General Virology. 100 (3): 367–368. doi:10.1099 / jgv.0.001212. PMC 6537627. PMID 30672729.
- ^ „10. zpráva ICTV (2018)“.
- ^ „Virus Taxonomy: 2019 Release“. talk.ictvonline.org. Mezinárodní výbor pro taxonomii virů. Citováno 27. dubna 2020.
- ^ A b C Gonçalves, M (2005). „Virus spojený s adeno: od vadného viru po účinný vektor“. Virology Journal. 2 (1): 43–60. doi:10.1186 / 1743-422X-2-43. PMC 1131931. PMID 15877812.
- ^ A b Správa ICTVdB (2006). Büchen-Osmond, C. (ed.). „ICTVdB - Univerzální virová databáze, verze 4: Dependovirus“. Columbia University, New York, USA. Citováno 4. května 2009.
- ^ Excoffon, K; et al. (2009). "Cílený vývoj adeno-asociovaného viru na infekční respirační virus". Sborník Národní akademie věd. 106 (10): 3865–3870. Bibcode:2009PNAS..106,3865E. doi:10.1073 / pnas.0813365106. PMC 2646629. PMID 19237554.
- ^ Ghosh, A .; Yue, Y .; Lai, Y. & Duan, D. (2008). „Hybridní vektorový systém rozšiřuje kapacitu balení virových vektorů souvisejících s adenem způsobem nezávislým na transgenu“ (PDF). Molekulární terapie. 16 (1): 124–130. doi:10.1038 / sj.mt.6300322. PMID 17984978.
