Kyanurický triazid - Cyanuric triazide - Wikipedia
tento článek potřebuje další citace pro ověření. (Květen 2013) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC 2,4,6-Triazido-1,3,5-triazin | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C3N12 | |
| Molární hmotnost | 204.117 g · mol−1 |
| Vzhled | bílý krystal |
| Hustota | 1,73 g · cm−3[1] |
| Bod tání | 94 ° C (201 ° F; 367 K) |
| Bod varu | 150 ° C (302 ° F; 423 K) Rozklad nebo výbuch |
| Nebezpečí | |
| Hlavní nebezpečí | Hořlavý a dráždivý |
| Piktogramy GHS |  |
| Bod vzplanutí | [2] |
| 205 ° C (401 ° F; 478 K) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyanurický triazid (C3N12 nebo (NCN3)3) je popisován jako ekologický, nízko toxický a organický primární výbušnina s detonační rychlost asi 7 300 m · s−1, a teplota vzplanutí při 205 ° C. Primární výzkum této sloučeniny se zaměřuje na její vysoké využití hustota energie sloučenina.
Struktura
Kyanurový triazid je rovinný a má trojnásobnou osovou symetrii skládající se ze střídajících se atomů uhlíku a dusíku, jejichž středy se střídají od sebe 1,38 Á a 1,31 Á. Vzdálenost mezi středem kruhu a atomy uhlíku každého z atomů dusíku je 1,30 Á a 1,39 Á. Toto upevnění polohy vazeb v cyanurickém kruhu je způsobeno hlavně nesymetrickými polohami azidových řetězců. Azidové skupiny jsou spojeny s atomy uhlíku na kyanurickém kruhu jednoduchými vazbami s interatomovou vzdáleností 1,38 Å, podobně jako samotný cyanurový kruh.
Výskyt
Tato sloučenina je čistě syntetická, a proto v přírodě neexistuje.
Syntéza
Kyanurový triazid lze syntetizovat nukleofilní aromatickou substitucí za použití chlorid kyanurový s přebytkem azid sodný zahřívá se pod zpětným chladičem aceton řešení. Bílé krystaly pak mohou být čištěny krystalizací při -20 ° C toluen.[3]
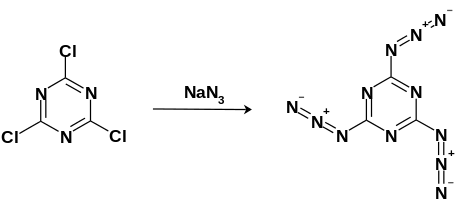
Rozkladné reakce
Bylo zjištěno, že tato bílá polykrystalická pevná látka je stabilní za standardních podmínek, ale je extrémně citlivá na nárazy, což způsobí její prudký rozklad při mletí maltou. Termodynamické vlastnosti triazidu kyanurového byly studovány pomocí bombové kalorimetrie s a entalpie spalování (H) 2234 kJ · mol−1 za oxidačních podmínek a 740 kJ · mol−1 v opačném případě. První hodnota je srovnatelná s vojenskou výbušninou RDX, (C.3N3)(NE3)3H6, ale není uveden do provozu kvůli své méně příznivé stabilitě. Zkouška teploty tání ukázala ostrý rozsah tání do čiré kapaliny při 94-95 ° C, vývoje plynu při 155 ° C, zbarvení oranžového až hnědého roztoku při 170 ° C, oranžově hnědé tuhnutí při 200 ° C a rychlého rozkladu při 240 ° C . Rychlý rozklad při 240 ° C je výsledkem tvorby elementárního uhlíku jako grafit a vznik dusík plyn.[3]
Reference
- ^ Haynes, W. M .; Lide, D. R. (2012). CRC Handbook of Chemistry and Physics 93. Ed. CRC Press / Taylor and Francis. ISBN 1439880492.
- ^ Mikhail A. Ilyushin, Igor V. Tselinsky And Irina V. Shugalei (2012). „Ekologicky šetrné energetické materiály pro iniciační zařízení“ (PDF). Středoevropský věstník energetických materiálů. 9 (4): 293–327.
- ^ A b Gillan, Edward G. (2000). „Syntéza sítí s nitridem uhlíku bohatých na dusík z energetického prekurzoru molekulárního azidu“. Chemie materiálů. 12 (12): 3906. doi:10,1021 / cm000570y.
