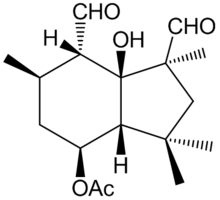
Botrydial - Botrydial
 | |
| Jména | |
|---|---|
| Název IUPAC [(LS, 3aR, 4S, 6R, 7S, 7aS) -l, 7-diformyl-7a-hydroxy-l, 3,3,6-tetramethyl-2,3a, 4,5,6,7-hexahydroinden-4 -yl] acetát | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C17H26Ó5 | |
| Molární hmotnost | 310,38534 g / mol |
| Hustota | 1,15 g / ml |
| Bod varu | 397,4 ° C (747,3 ° F; 670,5 K) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Botrydial je fytotoxický seskviterpen metabolit vylučovaný houbou Botrytis cinerea. Botrydial byl poprvé izolován a popsán v roce 1974.[1] Botrytis Cinerea je původcem onemocnění šedými plísněmi a je známo, že napadá širokou škálu rostlin (více než 200 druhů) produkujících nemoci listových skvrn a plísně na hlávkovém salátu a rajčatech i na hnijících bobulích.[2] Z tohoto důvodu představuje botrydial, stejně jako další seskviterpenové metabolity pocházející z Botrytis Cinerea, ekonomicky významné onemocnění pro okrasné a zemědělsky významné plodiny.[3] Ze všech metabolitů produkovaných touto houbou vykazuje Botrydial nejvyšší fytotoxickou aktivitu.[4]
Biosyntéza
Botrydial pochází z BcBOT2 (BotrytisCinerea BOTRydial biosynthesis) zprostředkovaná cyklizací farnesyl difosfátu (FPP) na klíčový meziprodukt tricyklický alkohol presilphiperfolan-8β-ol. Pinedo a kol. prokázal, že BcBOT2 je ve skutečnosti seskviterpen syntáza inkubací FPP s rekombinantním proteinem BcBOT2, který poskytl očekávaný presilphiperfolan-8-ol jako hlavní produkt. 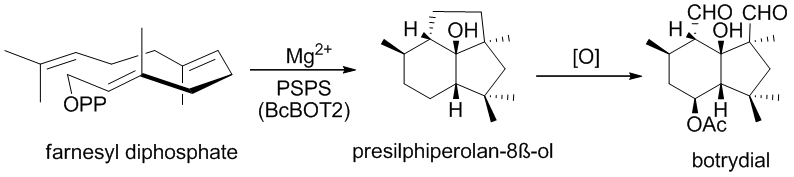
Na biosyntéze botrydial se poté podílejí 4 další geny: 3 geny, které kódují monooxygenázu P450 (BcBOT3, BcBOT1, BcBOT4) a gen BcBOT5, jehož aminokyselinová sekvence vykazovala vysokou homologii se známými acetyltransferázami.
To přineslo Pinedo et al. k závěru, že BcBOT5 je pravděpodobně zodpovědný za zavedení acetylové skupiny na C-4. Z kvantitativní analýzy reverzní transkripce-PCR (qRT-PCR) také dospěli k závěru, že pět po sobě jdoucích genů je společně regulováno stejnou transdukční cestou BCG1-kalcineurim.[5]
Mechanismus enzymatické tvorby presilphiperfolan-8β-ol
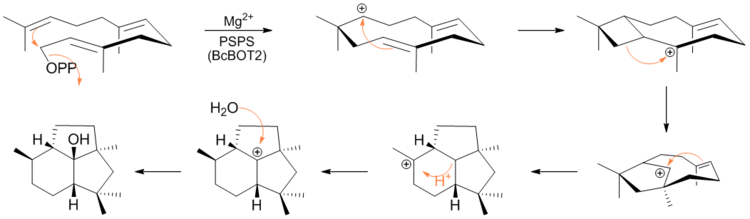
Nedávno v článku ASAP v The Journal of the American Chemistry Society, Cane et al. experimentálně potvrzeno pomocí deuteriového značení a NMR spektroskopie, mechanismu, kterým FPP cyklizuje na presilphiperfolan-8β-ol. Mechanismus spočívá v eliminaci difosfátové skupiny následované karbokací zprostředkovanými cyklizacemi a přesmyky.[6]
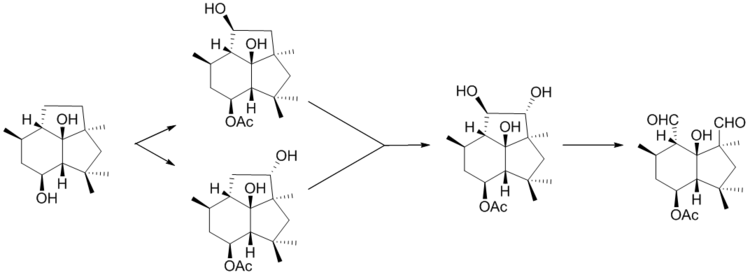
Po vytvoření presilphiperfolan-8β-olu BcBOT5 ustupuje acetylaci polohy C-4, poté dochází k hydroxylaci probotryanového skeletu ve dvoustupňovém procesu, po kterém následuje oxidativní štěpení nově vytvořeného diolu, čímž se získá botrydial.[7]
Mechanismus účinku
Botrydial produkuje Botrytis Cinerea, když je infikována hostitelská rostlina. Výsledkem je, že botrydial vyvolává chlorózu a kolaps buněk.[8] Navíc agresivní kmeny tajemství hub polyketidy jako je kyselina botcinová, která vykazuje fytotoxickou a antifungální aktivitu.[5]
Poznámky
- ^ Lindner, H.J .; von Groose, B. Chem. Ber. 1974, 107, 3332-3336
- ^ Collado, I.G .; Hernandez-Galan, R .; Duran-Patron, R .; Cantoral, J.M. Phytochemistry. 1995, 38, 647-650
- ^ a) Williamson, B .; Tudzynski, B .; Tudzynski, P .; van Kan, J. A. Mol. Plant Pathol. 2007, 8, 561–580. (b) Choquer, M .; Fournier, E .; Kunz, C .; Levis, C .; Pradier, J. M .; Simon, A .; Viaud, M. FEMS Microbiol. Lett. 2007, 277, 1–10
- ^ Colmenares, A. J .; Aleu, J., Duran-Patron, R .; Collado, I. G .; Hernandez-Galan, R. J. Chem. Ecol. 2002, 28, 997-1005
- ^ A b Pinedo, C .; Wang, C. M .; Pradier, J. M .; Dalmais, B .; Choquer, M .; Le Pecheur, P .; Morgant, G .; Collado, I. G .; Cane, D.E .; Viaud, M. ACS Chem. Biol. 2008, 3, 791-801.
- ^ Wang, C .; Hopson, R .; Lin, X .; Cane, D.E. J. Am. Chem. Soc. 2009, ASAP, doi:10.1021 / ja9021649
- ^ Duran-Patron, R .; Colmenares, A.J .; Hernandez-Galan, R .; Collado, I.G. Čtyřstěn. 2001, 57, 1929-1933
- ^ Deighton, N .; Muckenschnabel, I .; Colmenares, A. J., Collado, I. G .; Williamson, B. Phytochemistry 2001 57, 689-692
