Automatická opravná svorka - Automated patch clamp
Automatické upínání patchů začíná[1] vyměnit manuál upnutí záplaty jako metoda měření elektrické aktivity jedince buňky. K automatizaci nahrávek patch clamp z buněk v se používají různé techniky buněčná kultura a in vivo. Tato práce pokračuje od konce 90. let výzkumnými laboratořemi a společnostmi, které se snaží snížit její složitost a náklady na ruční upínání patchů. Upínání záplat po dlouhou dobu bylo považováno za uměleckou formu a je stále velmi časově náročné a zdlouhavé, zejména in vivo. Techniky automatizace se snaží snížit chyby uživatelů a variabilitu při získávání kvality elektrofyziologie záznamy z jednotlivých buněk.
Ruční svorka
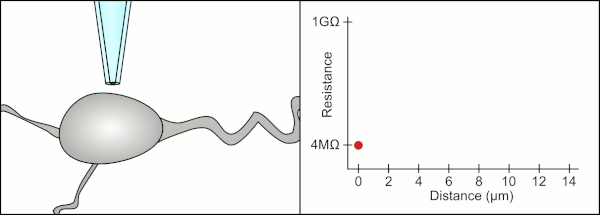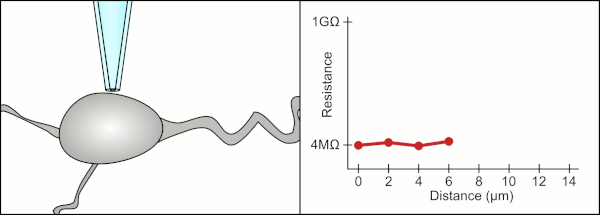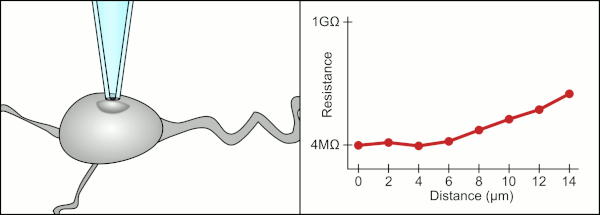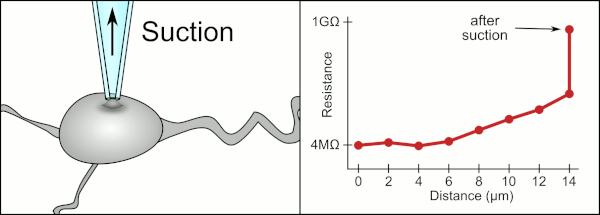
Tradiční manuální metodu pro připojení svorky pomocí skleněných pipet vyvinula společnost Erwin Neher a Bert Sakmann a vyžadoval vysoce kvalifikovaného technika. Technik umístí skleněnou pipetu do blízkosti buňky a použije příslušné sání, aby vytvořil elektrické těsnění mezi pipetou a membránou buňky. Toto těsnění zajišťuje kvalitní záznam tím, že zabraňuje úniku jakéhokoli proudu mezi špičkou pipety a buněčnou membránou. Toto utěsnění se vytvoří, když se membrána buňky chemicky váže na špičku pipety, takže vnitřek pipety je spojen pouze s cytoplazma buňky. Toto spojení nebo těsnění z membrány a skla se nazývá „gigaseal“.[2]
Technik tradičně používal jejich ústa k zajištění přesných tlaků potřebných k jejich utěsnění do cely. Kromě kontroly tlaku musí technik také umístit pipetu přesně do správné vzdálenosti od buňky, aby s ní membrána utěsnila. Používat mikromanipulátor se pipeta pohybuje směrem k cele, dokud technik neuvidí změnu elektrického odporu mezi tekutinou uvnitř pipety a okolní tekutinou (viz animace). To obvykle vyžaduje 3–12 měsíců školení, než je technik schopen spolehlivě zaznamenávat z buněk. Technik v podstatě provádí vyvažovací úkon a snaží se sledovat a manipulovat s několika systémy současně (pohyb, tlak a elektrické signály). Pokud nebude každá část procesu provedena přesně a se správným načasováním, těsnění nebude vytvořeno správně a technik bude muset vyměnit pipetu a začít znovu.
Tyto výzvy snižují počet nahrávek, které může technik získat, a výrazně zvyšují náklady. Automatizace usiluje o snížení času, složitosti a nákladů na ruční upínání patchů.
Automatizační systémy
Technika automatizace se liší v závislosti na okolním prostředí buněk. U buněk in vivo to obvykle znamená, že jsou buňky v mozku a obklopeny jinými buňkami. Toto prostředí také obsahuje cévy, dendrity, axony, a gliové buňky což ztěžuje vytvoření gigasealu ucpáním špičky pipety o průměru 1–2 m. Zde hraje přesná kontrola tlaku a polohy na špičce pipety velkou roli v prevenci ucpání a detekci, zda je buňka blízko špičky pipety, jak je popsáno výše.
Buňky in vitro mohou být suspendovány v tekutině, připraveny k přilnutí na kultivační misku nebo zůstat součástí kousku tkáně, který byl ze zvířete odstraněn. Tato prostředí obvykle nemusí kompenzovat pohyb tkáně v důsledku srdečního rytmu nebo dýchání zvířete. V případě buněk v suspenzi je pipeta zcela nahrazena mikročipem s otvory, které mohou vytvářet gigaseal a měřit elektrickou aktivitu. Ucpávání je také méně problematické pro buňky nebo tkáně v kultivačních miskách, protože buňky a pipetu lze pozorovat mikroskopem, který technikovi pomáhá vyhnout se všemu kromě požadované buňky.
Každý z těchto automatizovaných systémů musí provádět několik úkolů. Musí umístit článek vedle špičky pipety nebo jiného zařízení s otvorem o velikosti 1–2 μm, kontrolovat tlak v otvoru a řídit napětí uvnitř článku.
In vivo
Jeden příklad upnutí náplasti in vivo ukázal Kodandaramaiah, et al.[3] V tomto případě se regulace tlaku skládala ze sady elektronických ventilů a elektronických regulátorů tlaku, které zajišťovaly tři tlaky, které dříve zajišťoval technik (vysoký tlak 800 - 1 000 mbar, nízký tlak 20 - 30 mbar a malé vakuum 15 - 150 mbar). Tři elektronické ventily přepínaly mezi třemi tlaky a atmosférickým tlakem. Vysoký tlak byl použit, aby se zabránilo ucpání pipety, nízký tlak byl použit při hledání buněk a vakuum bylo použito k procesu gigasealingu. Všechny byly řízeny počítačem, aby bylo možné volit mezi tlaky, jak se mění odpor na špičce pipety.
Ruční ovládání polohy bylo v tomto případě nahrazeno počítačem piezoelektrický mikromanipulátor který pohyboval pipetou v diskrétních 2–3 μm krocích do tkáně, dokud se nedostala do kontaktu s buňkou. Toto přesné ovládání je mnohem přesnější a opakovatelnější než ruční určování polohy a nevyžaduje obsluhu.
Počítač také vypočítává a sleduje změnu elektrického odporu při kontaktu pipety s buňkou. Vysílá napěťový signál ve formě čtvercové vlny dolů po pipetě, která buď vystupuje z konce pipety, nebo je blokována buněčnou membránou. Když to membrána zablokuje, počítač zastaví pohyb pipety a aplikuje sání, aby vytvořil gigaseal. Tato automatizace vylučuje rozhodování, které technik musel provádět, a na rozdíl od technika může počítač tyto úkoly provádět neúnavně a s větší přesností.
Všechny tyto kroky se provádějí ve stejné logické posloupnosti jako ruční upínání patchů, ale jejich provedení nevyžaduje rozsáhlé školení a jsou zcela řízeny počítačem. To snižuje výdaje potřebné k získání nahrávek patch clamp a zvyšuje opakovatelnost a robustnost záznamu v živém mozku.
V pozastavení


Bylo vyvinuto mnoho typů systémů pro upínání buněk v suspenzních kulturách. Jeden systém používá tradiční pipetu a buňky v kapkové suspenzní kultuře k získání záznamů patch clamp (viz obrázek). To má další výhodu v použití tradičních systémů pro výrobu pipet, které ohřívají skleněnou kapiláru a podélně ji táhnou, aby se vytvořil zúžený hrot používaný při upínání náplastí.
Běžnější automatizační systémy pro suspenzní kultury používají mikročipy s malými (1–2 μm) otvory v planárním substrátu místo pipet k vytvoření gigaseal a záznamu z jednotlivých buněk. Patch čipy byly vyvinuty počátkem dvacátých let v důsledku vylepšení mikrofabrikace technologie vyvinuté polovodič průmysl. Čipy se obvykle vyrábějí z křemík, sklenka, PDMS, polyamid. Systémy patch čipů jsou obvykle složitější a nákladnější, ale mají další výhodu paralelního a hands-free provozu.[4][5][6]
Neurony obvykle nerostou v suspenzních kulturách, ale jiné typy buněk mohou. Některé mohou být transfektovaný s geny k vytvoření membrány iontové kanály zájmu. To znamená, že buňka, která normálně nemá elektrickou aktivitu, může ve své membráně růst iontové kanály, které budou generovat iontové proudy. Protože jsou buňky v suspenzních kulturách navzájem disociovány, lze iontové proudy v jedné buňce měřit s přesností. To vědcům umožňuje studovat chování iontových kanálů ve více kontrolovaných prostředích bez rušení proudů z jiných buněk, jak se obvykle vyskytuje v neuronových sítích. To je zvláště užitečné při screeningových studiích, kde cílem je specifický protein.[7] Protože manipulace s buňkami v suspenzi je mnohem snazší než manipulace s buňkami v kultuře nebo in vivo, lze tímto způsobem získat záznamy patch clamp mnohem rychleji a spolehlivěji, což zvyšuje produktivitu a umožňuje screening tisíců sloučenin.[8]
Neurony odvozené od kmenové buňky kultivované adherentně mohou být zvednuty do suspenze a byly úspěšně použity na planárních svorkách upínacích zařízení.[9] Ionové kanály jako např napěťově řízené sodíkové kanály, napěťově řízené draslíkové kanály a ionotropní ligandem řízené iontové kanály otevřel ligand GABA byly zaznamenány z těchto buněk pomocí automatizované a ruční svorky.[10]
V kultuře
Existuje mnoho metod in vitro pro automatické upínání náplastí kultivovaných buněk nebo řezů mozkové tkáně.
Jeden používá patchový čip, jako jsou ty diskutované výše, spolu s povrchovými úpravami, které způsobují, že kultivované buňky migrují do otvorů, kde se při růstu tvoří gigaseal.[11] Tím, že umožňují neuronům růst v kultuře, vytvářejí spontánně sítě, jako jsou ty v mozku, které jsou spíše jako přirozené tkáně než izolované buňky v suspenzi.
V jiné metodě jsou buňky odebrány ze zvířete a kultivovány na čipu náplasti po dobu 2–4 hodin, protože spontánně tvoří gigaseal s polyimid a PDMS opravné čipy [12] Tento systém nevyžaduje žádné externí zařízení k vytváření gigasealů.
Další technika automatizuje umisťování buněk upínajících náplast v kulturách. Využívá nanopipetu na precizním, piezoelektrickém stole ke skenování povrchu v kultivační misce. Při skenování udržuje konstantní elektrickou kapacitu mezi špičkou pipety a povrchem nebo buňkami pod ní pohybem nahoru a dolů. (Jak se pohybuje v blízkosti buňky, zvyšuje se kapacita, takže akční člen pohybuje pipetou pryč a naopak.) Tím se získá přesné topografické mapování povrchu v kultivační misce. Poté, co byly buňky mapovány, počítač přesune pipetu na vybranou buňku a spustí ji, aby s ní vytvořil gigaseal.[13]
Jiná technika jednoduše automatizuje podnikání při pečlivém kontaktu s buňkami. Operátor umístí pipetu na vzorek a poté nechá převzít automatizovaný software, spustí pipetu a snaží se detekovat zvýšení odporu na pipetě při kontaktu s buňkou. V tomto okamžiku proces končí a technik vytvoří gigaseal ručně.
Vývoj a přijetí
Patch-clamp automatizační přístrojové vybavení se stalo komerčně dostupným v roce 2003. Kvůli počátečním vysokým nákladům měla být tato téměř 20 let stará technologie původně určena pro biotechnologický a farmaceutický průmysl, ale v posledních letech její přítomnost roste v akademickém i neziskovém prostředí vzhledem k rostoucí ověřené technické spolehlivosti a relativní cenové dostupnosti. Rostoucí počet univerzit a dalších akademických institucí nyní disponuje laboratořemi a základními zařízeními vybavenými automatickými aparáty patch-clamp ve spojení a souběžně s dalšími přidruženými nebo doplňkovými technologiemi a metodami.[14] Přijetí a uznání automatizace patch-clamp elektrofyziologie se odráží v exponenciálním růstu vědecké literatury publikované s výsledky získanými touto revoluční novou technologií [15]
Reference
- ^ Wood, C .; Williams, C .; Waldron, G. J. (2004). Msgstr "Upínání záplat podle čísel". Objev drog dnes. 9 (10): 434–441. doi:10.1016 / S1359-6446 (04) 03064-8. PMID 15109948.
- ^ Hamill, O. P .; Marty, A .; Neher, E .; Sakmann, B .; Sigworth, F. J. (1981). "Vylepšené techniky patch-clamp pro záznam proudu s vysokým rozlišením z buněk a bezbuněčných membránových záplat". Archiv Pflügers: European Journal of Physiology. 391 (2): 85–100. CiteSeerX 10.1.1.456.107. doi:10.1007 / BF00656997. PMID 6270629.
- ^ Kodandaramaiah, Suhasa B; Franzesi, Giovanni Talei; Chow, Brian Y; Boyden, Edward S; Forest, Craig R (2012). „Automatizovaná elektrofyziologie neuronů neuronů in vivo v celé buňce“. Přírodní metody. 9 (6): 585–587. doi:10.1038 / nmeth.1993. ISSN 1548-7091. PMC 3427788. PMID 22561988.
- ^ Jones, K. A .; Garbati, N .; Zhang, H .; Large, C. H. (2009). Msgstr "Automatické upínání záplat pomocí QPatch". Vysoce výkonné prověřování. Metody v molekulární biologii. 565. 209–23. doi:10.1007/978-1-60327-258-2_10. ISBN 978-1-60327-257-5. PMID 19551364.
- ^ Chen, C. Y .; Tu, T. Y .; Chen, C.H .; Jong, D. S .; Wo, A. M. (2009). „Patch upnutí na rovném skle - výroba clony přesýpacích hodin a záznam iontového kanálu s vysokým výtěžkem“. Laboratoř na čipu. 9 (16): 2370–2380. doi:10.1039 / B901025D. PMID 19636469.
- ^ Obergrussberger, Alison; Stölzle-Feix, Sonja; Becker, Nadine; Brüggemann, Andrea; Fertig, Niels; Möller, Clemens (2015). „Nové screeningové techniky pro léky zaměřené na iontové kanály. Kanály. 9 (6): 367–375. doi:10.1080/19336950.2015.1079675. PMC 4850050. PMID 26556400.
- ^ Dunlop, J .; Bowlby, M .; Peri, R .; Vasilyev, D .; Arias, R. (2008). „High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology“. Recenze přírody Objev drog. 7 (4): 358–368. doi:10.1038 / nrd2552. PMID 18356919.
- ^ Obergrussberger, Alison; Brüggemann, Andrea; Goetze, Tom; Radedius, Markus; Haarmann, Claudia; Rinke, Ilka; Becker, Nadine; Dobře, Takayuki; Ohtsuki, Atsushi; Stengel, Timo; Vogel, Marius; Steindl, Jürgen; Mueller, Max; Stiehler, Johannes; George, Michael; Fertig, Niels (2016). „Automatizovaná propojovací svorka splňuje vysokovýkonný screening: 384 buněk zaznamenaných paralelně na planárním spojovacím modulu“. Journal of Laboratory Automation. 21 (6): 779–793. doi:10.1177/2211068215623209. PMID 26702021.
- ^ Haythornthwaite, Alison; Stölzle, Sonja; Hasler, Alexander; Kiss, Andrea; Mosbacher, Johannes; George, Michael; Brüggemann, Andrea; Fertig, Niels (2012). „Charakterizace lidských iontových kanálů v indukovaných neuronech odvozených z pluripotentních kmenových buněk“. Journal of Biomolecular Screening. 17 (9): 1264–1272. doi:10.1177/1087057112457821. PMID 22923790.
- ^ Haythornthwaite, Alison; Stölzle, Sonja; Hasler, Alexander; Kiss, Andrea; Mosbacher, Johannes; George, Michael; Brüggemann, Andrea; Fertig, Niels (2012). „Charakterizace lidských iontových kanálů v indukovaných neuronech odvozených z pluripotentních kmenových buněk“. Journal of Biomolecular Screening. 17 (9): 1264–1272. doi:10.1177/1087057112457821. PMID 22923790.
- ^ Py, C .; Martina, M .; Diaz-Quijada, G. A .; Luk, C. C .; Martinez, D .; Denhoff, M. W .; Charrier, A .; Comas, T .; Monette, R .; Krantis, A .; Syed, N. I .; Mealing, G. A. R. (2011). „Od porozumění buněčné funkci k novému objevu léčiv: Role technologie planárního čipu Patch-Clamp Array“. Hranice ve farmakologii. 2: 51. doi:10.3389 / fphar.2011.00051. PMC 3184600. PMID 22007170.
- ^ Martinez, D .; Py, C .; Denhoff, M. W .; Martina, M .; Monette, R .; Comas, T .; Luk, C .; Syed, N .; Mealing, G. (2010). „Vysoce věrné záznamy patch-clamp z neuronů kultivovaných na polymerním mikročipu“. Biomedicínské mikrozařízení. 12 (6): 977–985. CiteSeerX 10.1.1.362.9850. doi:10.1007 / s10544-010-9452-z. PMID 20694518.
- ^ Gorelik, J .; Gu, Y .; Spohr, H. A .; Shevchuk, A. I .; Lab, M. J .; Harding, S.E .; Edwards, C. R. W .; Whitaker, M .; Moss, G. W. J .; Benton, D. C. H .; Sánchez, D .; Darszon, A .; Vodyanoy, I .; Klenerman, D .; Korchev, Y. E. (2002). „Iontové kanály v malých buňkách a subcelulárních strukturách lze studovat pomocí inteligentního systému Patch-Clamp“. Biofyzikální deník. 83 (6): 3296–3303. Bibcode:2002BpJ .... 83,3296G. doi:10.1016 / S0006-3495 (02) 75330-7. PMC 1302405. PMID 12496097.
- ^ Picones, A .; Loza-Huerta, A .; Segura-Chama, P .; Lara-Figueroa, C.O. (2016). "Příspěvek automatizovaných technologií k objevování drog na iontovém kanálu". Adv Protein Chem Struct Biol. 104: 357–378. doi:10.1016 / bs.apcsb.2016.01.002. PMID 27038379.
- ^ Picones, A. (2015). „Ion kanály jako léčivé cíle biologických toxinů: dopad automatizované elektrofyziologie patch-clamp“. Curr Top Med Chem. 15 (7): 631–637. doi:10.2174/1568026615666150309145928. PMID 25751269.
