Absinthin - Absinthin
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC (1R, 2R, 5S, 8S, 9S, 12S, 13R, 14S, 15S, 16R, 17S, 20S, 21S, 24S) -12,17-dihydroxy-3,8,12,17,21,25-hexamethyl- 6,23-dioxaheptacyklo [13.9.2.01,16.02,14.04,13.05,9,020,24] hexakosa-3,25-dien-7,22-dion | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C30H40Ó6 | |
| Molární hmotnost | 496.635 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Absinthin je přirozeně produkovaný triterpenový lakton z rostliny Artemisia absinthium (Pelyněk ). Představuje jeden z nejvíce hořkých chemických činitelů, za které je zodpovědný Absint výrazná chuť.[1] Sloučenina ukazuje biologická aktivita a prokázal slib jako protizánětlivý prostředek,[2] a neměla by být zaměňována s thujon, neurotoxin také nalezený v Artemisia absinthium.
Chemická struktura
Komplexní struktura Absinthinu (1) je klasifikována jako seskviterpenový lakton, což znamená, že patří do velké kategorie přírodních produktů chemicky odvozených z 5-uhlíkových „stavebních bloků“ (3) odvozených z isopren (4). Celá struktura se skládá ze dvou identických monomerů (2), které jsou připojeny prostřednictvím podezření na přirozeně se vyskytující Diels Alder reakce probíhající u alkenů na 5členném kruhu guaianolidu.
 Ilustrace isoprenoid komponenty zapojené do biosyntéza Absinthin
Ilustrace isoprenoid komponenty zapojené do biosyntéza Absinthin
Celková syntéza
Celková syntéza (+) - Absinthinu provedli v roce 2004 Zhang a kol.[3] Konečný výtěžek uváděný pro syntézu byl 18,6% v průběhu 10 kroků pocházejících z Santonin (1), komerčně dostupné činidlo. Základem syntézy byla kruhová expanze původního šestičlenného uhlíkového kruhu na sedmičlenný kruh, která způsobila tvorbu lešení monomeru guaianolidu (2), následované Diels Alder kopulace (3) a konečné stereochemické modifikace vedoucí k (+) - Absinthinu (4).

Biosyntéza
Úplná biosyntéza Absinthinu v Artemisia absinthium nebyl objasněn, ale jeho velkou část lze odvodit z prekurzorů přírodních produktů potřebných pro přístup k Absinthinu. I když lze říci, že terpenoidy jako Absinthin sestávají z isopren "Jednotky," isopren sama o sobě je nestabilní a nereaguje přímo. Izoprenové jednotky se spíše přenášejí a reagují jako difosfáty. Jak naznačuje nomenklatura terpenů, první předchůdce Absinthinu farnesyl difosfát [A] obsahuje 15 uhlíků nebo 3 isoprenové jednotky. Difosfátový odchod (1) generuje karbo-kation v syntáze, který pak může být napaden dvojnou vazbou uhlík-uhlík na opačném konci molekuly (2). Prvním stabilním meziproduktem v biosyntetické dráze v Artemisii je pravděpodobně Germacrene A [B], který byl dříve identifikován v rostlinných seskviterpenových drahách jako předchůdce guaianolidů.[4] Odtud nastává hydroxylace (3), následovaná oxidací (4) na aldehyd přímo následovanou další hydroxylací (5) a tvorbou karboxylové skupiny. Je důležité si povšimnout zmizení koncové dvojné vazby uhlík-uhlík po (4), protože redukce této vazby v konečném produktu odlišuje monomér Absinthin od ostatních následných produktů Germacrene A. Toto snížení nemusí nutně nastat v kroku (4), ale může nastat dále po proudu. S karboxylovou a hydroxylovou skupinou v poloze může nastat tvorba guaiano-laktonu [C] dehydratací (7), jak je navrženo pro obecnou cestu guaianolidu.[5] Tvorba monomeru [D] sesquiterpenu guaianolidu [D] z hydroxylace a přesmyku dvojné vazby (8,9) se pak předpokládá, že přímo předchází dimerizaci na Absinthin [E] prostřednictvím přirozeně se vyskytujícího Diels-Alder reakce [10], která je pravděpodobně usnadněna přidruženou syntázou, i když k samotné reakci může dojít v dobrých výtěžcích spontánně,[3] i když pomalejší než biosyntéza typického přírodního produktu.
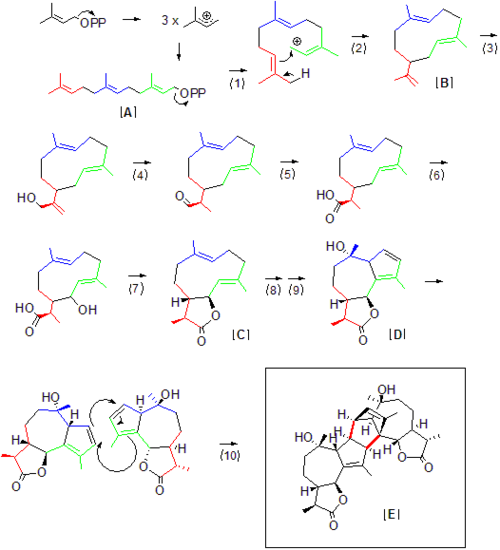
I když žádné syntázy specifické pro Artemisia absinthium byly dostatečně izolovány, aby znovu vytvořily tuto konkrétní tvorbu sesquiterpenu in vitro, zde uvedené obecné reakční schéma zobrazuje pravděpodobný scénář pro biosyntézu Absinthinu pomocí terpenových meziproduktů používaných při biosyntéze Germacrenu A, dalšího seskviterpenového laktonu. Enzymatické analogy z biosyntézy terpenů, které pomáhají racionalizovat výše navržené číslované kroky biosyntézy, jsou následující:
- Farnesyl difosfát odchod pomocí generické seskviterpenové syntázy [6]
- Uzávěr kruhu pomocí generické seskviterpenové syntázy (jako u # 1)[6]
- Hydroxlace koncového allylového uhlíku prostřednictvím germázy (hydroxyacáza A), enzymu cytochromu P450.[6]
- Oxidace alkoholu na aldol, via -germacren A hydroxyláza.[6]
- Hydroxylace alkoholu na karboxylovou skupinu, pomocí hydroxylázy Germacrene A.[6]
- NADPH zprostředkovaná hydroxlace allylového uhlíku postulovanou hydroxylací, která předchází uzavření laktonového kruhu [6]
- Tvorba laktonu / uzavření kruhu [6]
- Hydroxylace na terciární dvojné vazbě uhlík-uhlík.
- Další tvorba / cyklizace pětičlenného kruhu [4]
- Diels-Alder kopulace prostřednictvím neidentifikovaného enzymu v Artemisia absinthium.
Reference
- ^ Lachenmeier DW, Walch SG, Padosch SA, Kröner LU (2006). "Absint - recenze". Crit Rev Food Sci Nutr. 46 (5): 365–77. doi:10.1080/10408690590957322. PMID 16891209. S2CID 43251156.
- ^ Bazhenova E.D .; Ashrafova R. A .; Aliev K.U .; Tulyaganov; P. D. (1977). Chem. Abstr. 87: 193909f.CS1 maint: periodikum bez názvu (odkaz)
- ^ A b C Zhang W, Luo S, Fang F a kol. (Leden 2005). "Celková syntéza absinthinu". J. Am. Chem. Soc. 127 (1): 18–9. doi:10.1021 / ja0439219. PMID 15631427.
- ^ A b de Kraker JW, Franssen MC, de Groot A, Konig WA, Bouwmeester HJ (srpen 1998). „(+) - Germacrene A Biosynthesis: The Committed Step in the Biosynthesis of Bitter Sesquiterpene Lactones in Chicory“. Plant Physiol. 117 (4): 1381–92. doi:10.1104 / pp.117.4.1381. PMC 34902. PMID 9701594.
- ^ Kelsey, R.G .; Shafizadeh, F. (1979). "Sesquiterpenové laktony a systematika rodu Artemisia". Fytochemie. 18 (10): 1591–1611. doi:10.1016/0031-9422(79)80167-3.[mrtvý odkaz ]
- ^ A b C d E F G de Kraker JW, Franssen MC, Dalm MC, de Groot A, Bouwmeester HJ (duben 2001). „Biosyntéza germakrenu A karboxylové kyseliny v kořenech čekanky. Demonstrace cytochromu P450 (+) - germakren A hydroxylázy a na NADP + závislé sekviterpenoiddehydrogenáze zapojené do biosyntézy seskviterpenu laktonu“. Plant Physiol. 125 (4): 1930–40. doi:10.1104 / pp.125.4.1930. PMC 88848. PMID 11299372.

