Abramovova reakce - Abramov reaction
| Abramovova reakce | |
|---|---|
| Pojmenoval podle | Vasilii S. Abramov |
| Typ reakce | Vazební reakce |
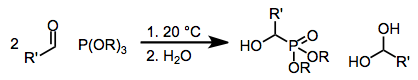
The Abramovova reakce je související přeměna trialkylu na a-hydroxyfosfonáty přidáním ke karbonylovým sloučeninám. Pokud jde o mechanismus, reakce zahrnuje útok nukleofilního atomu fosforu na karbonylový uhlík.[1] Název dostal podle ruského chemika Vasilije Semenoviče Abramova (1904–1968) v roce 1957.[2]
Úvod
Zdroje fosforu bohaté na elektrony, jako jsou fosfity, fosfonity a fosfinity, mohou v jednoduchých karbonylových sloučeninách podstoupit nukleofilní přidání k atomům uhlíku. Pokud se použijí plně esterifikované fosfity (Abramovova reakce), neutralizace výsledného čtyřstěnného meziproduktu obvykle probíhá přenosem alkylové nebo silylové skupiny z kyslíku připojeného k fosforu do nově vytvořeného alkoxidového centra. Je také možné přidání konjugátu,[3] a po přenosu skupiny poskytuje y-funkcionalizované karbonylové sloučeniny nebo enolethery. Použití zdrojů fosforu obsahujících siloxy velmi rozšířilo rozsah této reakce, protože výsledné α-siloxy sloučeniny lze převést na odpovídající α-hydroxy deriváty v přítomnosti alkoholového rozpouštědla[4]
(1)

Mechanismus a stereochemie
Převládající mechanismus
Fosfity se reverzibilně přidávají na karbonylový uhlík jednoduchých karbonylových sloučenin. Za mírných podmínek je reverze k výchozím materiálům rychlejší než přenos inter- a intramolekulárních alkylových skupin - čtyřstředový přechodový stav pro intramolekulární přenos vykazuje špatné orbitální překrývání.[5] Přenos lze usnadnit za podmínek vysoké teploty nebo tlaku. Pokud se použijí dva ekvivalenty aldehydu, vede přidání tetraedrického meziproduktu ke druhé molekule aldehydu buď k cyklickým fosforanům 1 nebo produkty lineárního přenosu alkylu 2.
Praktičtější je použití zdrojů silylovaného fosforu, které procházejí intramolekulárním přenosem silylových skupin přední stranou, čímž se získají sloučeniny α-siloxy fosforu 3.[6]
(3)

Rozsah a omezení
Fosforová činidla
Fosfity se běžně používají k výrobě a-hydroxyfosfonátů. V přítomnosti dvou ekvivalentů aldehydu cyklické fosforany 1 (rovnice 3) převládají, ale lze je snadno hydrolyzovat za vzniku odpovídajících hydroxyfosfonátů.[7]
(6)
Pokud se fosfonové kyseliny použijí v přítomnosti katalytického množství báze, může dojít k oxidům fosfinu. Sodné soli fosfonových kyselin v této souvislosti historicky dobře fungovaly a zásady jako jsou amid sodný bylo použito.[8] Asymetrickou indukci a selektivní přímé přidání (pro konjugované karbonylové sloučeniny) lze však dosáhnout v přítomnosti chirálních aminových bází.[9]
(7)

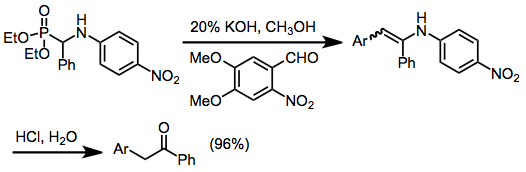
Objev a použití silylovaných fosforových činidel v této reakci představovalo metodický pokrok. K selektivnímu přenosu silylových skupin dochází ve směsných činidlech a štěpení výsledných vazeb křemíku na kyslík lze často provést hydrolyticky, což poskytuje přístup k a-hydroxyderivátům. Alkylace a-siloxy produktů poskytuje pohodlnou cestu k jinak obtížně přístupným sloučeninám a-alkoxy fosforu. Mohou fungovat jako ekvivalenty acylových aniontů, když jsou deprotonovány, a po odstranění za základních podmínek dávají ketony.[10]
(8)

Karbonylové substráty
Jednoduché ketony a aldehydy snadno podléhají přidání fosfitů na karbonylovém uhlíku. V jedné zajímavé aplikaci poskytuje přidání ketenů produkty identické s Arbuzovova reakce halogenidů kyselin.[11]
(9)

Reakci procházejí také α, β-nenasycené ketony a aldehydy. U dienylkarbonylových substrátů může dojít k 1,6-přidání, jako v příkladu níže.[12]
(10)

Iminy mohou také podstoupit reakci (Pudovikova reakce ), poskytující a-alkylaminofosfonáty.[13] Primární aminy lze vyrobit až po kyselé hydrolýze meziproduktu tert-butylamin;[14] použití nesubstituovaných iminů vyžaduje velmi drsné podmínky a poskytuje nízké výtěžky.
(11)

Syntetický nástroj
A-hydroxyalkylfosfonáty vyrobené touto metodou mohou být použity pro další transformace. Původní karbonylový uhlík je okyselen svou blízkostí k fosfonátové skupině. Deprotonace v této poloze generuje maskovaný acylový anion, protože fosfonátová funkční skupina může být odstraněna poté, co anion reaguje. Fosfonátové anionty mohou podléhat alkylaci a olefinaci ( Horner-Wadsworth-Emmonsova reakce ).[15] Pokud se při olefinaci použijí a-aminoalkylfosfonáty, mohou být výsledné enaminy hydrolyzovány na ketony.
(12)
Přidáním nenasycených karbonylových sloučenin a deprotonací se získá homoenolátový ekvivalent.
Srovnání s jinými metodami
Silylovaná fosfitová činidla jsou jedny z nejúčinnějších pro výrobu a-hydroxyfosfonátů. Existuje však několik dalších metod pro výrobu těchto sloučenin. Například přesmyk fosfát-fosfonát poskytuje a-hydroxyfosfonáty prostřednictvím tříčlenného cyklického meziproduktu.[16]
(13)

Experimentální podmínky a postupy
Obecně jsou reakce přidání fosforu provozně jednoduché. Roztoky reagencií v polárních (acetonitril, ethanol, tert-butanol) a nepolární (benzen ) lze použít rozpouštědla. Kyselá katalýza může být potřebná pro přidání fosfitových diesterů nebo pro in situ tvorba iminů. V prvním případě může být také použita bazická katalýza. Destilace je obecně dostačující k izolaci čistých produktů.
Viz také
- Reakce Michaelis – Arbuzov - reakce trialkylfosfitu a alkylhalogenidu za vzniku fosfonátu.
Reference
- ^ Engel, R. (2004). "Přidání fosforu v sp² Uhlík". Organické reakce: 175–248. doi:10.1002 / 0471264180.nebo036.02. ISBN 0471264180.
- ^ Аркадий Николаевич Пудовик. iopc.ru
- ^ Sekine, M .; Yamamoto, I .; Hashizume, A .; Hata, T. (1977). "Silylfosfity V. Reakce tris (trimethylsilyl) fosfitu s karbonylovými sloučeninami". Chem. Lett. 6 (5): 485–488. doi:10,1246 / tř. 1977,785.
- ^ Ranganathan, D .; Rao, B .; Ranganathan, S. (1979). „Nitroethylen: Syntéza nových 2-nitroethylfosfonátů“. J. Chem. Soc., Chem. Commun. (21): 975. doi:10.1039 / c39790000975.
- ^ Ginsberg, A .; Jakubovich, Y. (1960). Zh. Obshch. Khim. 30: 3979.CS1 maint: periodikum bez názvu (odkaz)
- ^ Sommer, H. Stereochemie, mechanismus a křemík„McGraw-Hill, New York, 1965, s. 176–178.
- ^ Ramirez, F .; Bhatia, B .; Smith, P. (1967). "Reakce trialkylfosfitů s aromatickými aldehydy". Čtyřstěn. 23 (5): 2067. doi:10.1016/0040-4020(67)80040-1.
- ^ Pudovik, A .; Arbuzov, A. (1950). Dokl. Akad. Nauk SSSR. 73: 327.CS1 maint: periodikum bez názvu (odkaz)
- ^ Wynberg, H .; Smaardijk, A. (1983). "Asymetrická katalýza při tvorbě vazby uhlík-fosfor". Tetrahedron Lett. 24 (52): 5899. doi:10.1016 / S0040-4039 (00) 94232-1.
- ^ Horner, H .; Roder, H. (1970). „Phosphororganische Verbindungen, 67. Notiz über die reduktive Umwandlung von Carbonsäuren in ihre Aldehyde“. Chem. Ber. 103 (9): 2984. doi:10.1002 / cber.19701030936.
- ^ Mirsalikhova, M .; Baranova, A .; Tunitskaya, L .; Gulyaev, N. (1981). Biokhimiya. 46: 258.CS1 maint: periodikum bez názvu (odkaz)
- ^ Arbuzov, A .; Fuzhenkova, V .; Rozhkova, F. (1982). J. Gen. Chem. SSSR. 52: 10.CS1 maint: periodikum bez názvu (odkaz)
- ^ Tyka, R. (1970). "Nová syntéza a-aminofosfonových kyselin". Tetrahedron Lett. 11 (9): 677–680. doi:10.1016 / S0040-4039 (01) 97800-1.
- ^ Moedritzer, K. (1970). "Nová syntéza kyseliny aminomethylfosfonové". Synth. Reagovat. Inorg. Metal-Org. Chem. 2 (4): 317–327. doi:10.1080/00945717208069617.
- ^ Wadsworth, W. (1977). "Syntetické aplikace fosforylem stabilizovaných aniontů". Org. Reagovat. 25: 73–253. doi:10.1002 / 0471264180.nebo025.02. ISBN 0471264180.
- ^ Sturtz, G .; Corbel, B .; Paugam, J.-P. (1976). „Nouveaux synthons phosphores: Bianions d'hydroxy-1 propene-2 YL phosphonamides, carbanions en β d'acides carboxyliques potentiels“. Tetrahedron Lett. 17: 47–50. doi:10.1016 / S0040-4039 (00) 71319-0.
