Kopytní protoparvovirus 1 - Ungulate protoparvovirus 1
| Kopytní protoparvovirus 1 | |
|---|---|
| Klasifikace virů | |
| (bez hodnocení): | Virus |
| Oblast: | Monodnaviria |
| Království: | Shotokuvirae |
| Kmen: | Cossaviricota |
| Třída: | Quintoviricetes |
| Objednat: | Piccovirales |
| Rodina: | Parvoviridae |
| Rod: | Protoparvovirus |
| Druh: | Kopytovitý protoparvovirus 1 |
| Členské viry[1] | |
Prasečí parvovirus | |
| Synonyma[2] | |
Prasečí parvovirus | |
Prasečí parvovirus (PPV), virus druhu Kopytní protoparvovirus 1 rodu Protoparvovirus v rodině virů Parvoviridae,[3] způsobuje reprodukční selhání svině charakterizovaný embryonální a fetální infekce a smrt, obvykle při absenci vnější matky klinické příznaky. Onemocnění se vyvíjí hlavně tehdy, když seronegativní matky jsou vystaveny viru orálně kdykoli během první poloviny roku těhotenství a koncepty jsou následně infikovány transplacentárně, než se stanou imunokompetentní. Neexistují žádné definitivní důkazy o tom, že by infekce prasat, jiná než během březosti, měla jakýkoli klinický nebo ekonomický význam. Virus je všudypřítomný mezi prasaty po celém světě a je enzootický ve většině stád, která byla testována. Diagnostické průzkumy ukázaly, že PPV je hlavní infekční příčinou embryonální a fetální smrti.[4][5][6][7][8] Kromě své přímé kauzální role při reprodukčním selhání může PPV potencovat účinky prasečí cirkovirus Infekce typu II (PCV2) v klinickém průběhu syndrom multisystémového plýtvání po odstavení (PMWS).[9][10]
Příznaky a symptomy
Akutní infekce postnatálních prasat, včetně březích samic, u kterých se následně vyvine reprodukční selhání, je obvykle subklinická.[11][12][13][14][15][16] U mladých prasat a pravděpodobně také u starších chovných zvířat se však virus extenzivně replikuje a nachází se v mnoha tkáních a orgánech s vysokou mitotický index. Virový antigen je zvláště koncentrován v lymfoidních tkáních[13][14] (Obr. 3A, B). Mnoho prasat, bez ohledu na věk nebo pohlaví, má přechodnou, obvykle mírnou, leukopenii někdy do 10 dnů po počáteční expozici viru.[11][17][15][16] PPV a další strukturně podobné viry byly identifikovány ve výkalech prasat s průjmem.[18][19] Neexistují však žádné experimentální důkazy, které by naznačovaly, že se PPV ve velké míře replikuje střevní krypta epitel nebo způsobuje střevní onemocnění stejně jako parvoviry několika dalších druhů.[13][20] PPV byl také izolován z prasat s lézemi popsanými jako vesikulové. Příčinná role PPV v takových lézích nebyla jasně definována.[21]
Hlavní a obvykle jedinou klinickou odpovědí na infekci PPV je reprodukční selhání matky. Patologické následky závisí hlavně na tom, kdy dojde k expozici během těhotenství. Přehrady se mohou vrátit do říje, nepodaří se porodit, přestože jsou v porodu, porodí několik prasat na vrh nebo porodí velkou část mumifikovaných plodů. Všechny mohou odrážet embryonální nebo fetální smrt nebo obojí. Jediným vnějším znakem může být snížení obvodu břicha matky, když plody zemřou při midgestaci nebo později a jejich přidružené tekutiny jsou resorbovány. Infekci PPV byly také připisovány další projevy reprodukčního selhání matky, jmenovitě neplodnost, potraty, mrtvě narozené děti, novorozenecká smrt a snížená vitalita novorozence.[4][22][23][24][25] Obvykle se jedná pouze o malou složku nemoci. Přítomnost mumifikovaných plodů ve vrhu může prodloužit obě těhotenství[24] a interval porodu.[26] Obojí může vést k mrtvému narození zjevně normálních spolužáků, ať už jsou nebo nejsou nakaženi.

Neexistují žádné důkazy o tom, že by plodnost nebo libido kanců je změněn infekcí PPV.[27][28]
Způsobit
PPV je zařazen do rodu Parvovirus (Latinsky parvus = malý) rodiny Parvoviridae.[29][30] Všechny izoláty PPV, které byly porovnány, byly shledány antigenně podobnými, ne-li identickými.[31][11][32][12][33] PPV je také antigenně příbuzný s několika dalšími členy rodu.[34][35][36] Jeho identita však může být stanovena relativně přísnými sérologickými testy, jako je neutralizace viru (VN) a inhibice hemaglutinace (AHOJ).
Biofyzikální a biochemické vlastnosti
Biofyzikální a biochemické vlastnosti PPV byly rozsáhle studovány[29][37][38] a jsou shrnuty následovně. Dospělý virion má kubickou symetrii, dva nebo tři kapsidové proteiny, průměr přibližně 20 nm, 32 kapsomerů, č obálka nebo esenciální lipidy a hmotnost 5,3 × 106 daltony. Virový genom je jednovláknový deoxyribonukleová kyselina (DNA) s a molekulární váha 1,4 × 106 (tj. přibližně 26,5% hmotnosti úplného virionu). Plovoucí hustoty (g / ml v chloridu cesném) úplných infekčních virionů, neúplných „prázdných“ virionů a extrahované virionové DNA je 1,38–1 395, 1,30–1 315 a 1,724. Virová infekčnost, hemaglutinační aktivita, a antigenicita jsou pozoruhodně odolné vůči teplu, širokému rozsahu koncentrací vodíkových iontů a enzymy.
Replikace
Replikace PPV in vitro je cytocidní a charakterizovaný „zaokrouhlováním nahoru“, pyknózou a lýza buněk (Obr. 1A). Mnoho z buněčné fragmenty často zůstávají připoutaní, což nakonec dává postižené kultuře drsný vzhled. Intranukleární inkluze rozvíjet[31] ale jsou často rozptýleny.[39] Infikované kultury mohou hemadsorb mírně[31] (Obr. 1B). Cytopatické změny jsou rozsáhlé, když se virus přizpůsobený buněčné kultuře množí za vhodných podmínek. Při počáteční izolaci však několik sériových pasáží viru[31] nebo lépe, infikovaná kultura může být nezbytná před rozpoznáním účinků. Použití imunofluorescence (LI) mikroskopie výrazně zvyšuje pravděpodobnost detekce minimálně infikovaných kultur.[40][41]
Primární a sekundární kultury fetálního nebo neonatálního prasete ledviny K šíření a titraci PPV se nejčastěji používají buňky, i když jsou také citlivé jiné druhy kultur.[42] Replikace je zvýšena infekcí mitoticky aktivních kultur.[31][43][44][45] Mnoho buněk v takových kulturách je ve fázi S (tj. Fázi syntézy DNA) svého buněčného cyklu, kde jsou k dispozici DNA polymerázy buněčného původu potřebné pro virovou replikaci.[46][47][48]
Pokud je plod nebo dospělý hovězí sérum je začleněno do živného média buněčných kultur používaných k propagaci PPV, mělo by být testováno na virové inhibitory.[49][50][51] Totéž může platit pro séra několika dalších druhů.[52] Protože replikace PPV je ovlivněna mitotickou aktivitou, je zvláště důležitý účinek séra na buňky. Kromě toho by kultury měly být testovány na kontaminaci PPV.[40][41] Kultury se někdy nevědomky připravují z infikovaných tkání plodu[41] a postnatální[31][53][54][55] prasata. Kromě toho může být PPV náhodně zaveden do kultur několika způsoby,[56] včetně použití kontaminovaného trypsinu.[57][58] Pokud je detekována kontaminace před infikováním všech buněk, může být virus eliminován opakovanou subkultivací buněk v přítomnosti živného média obsahujícího antisérum PPV.[59]
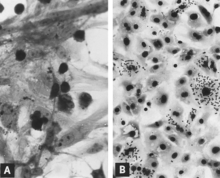
Několik výzkumníků použilo mikroskopii IF ke sledování vývoje PPV v buněčné kultuře.[31][40][60][61][62] Obecně je sled událostí následující. Virový antigen je detekován v cytoplazmě buněk brzy po infekci, pokud inokulum obsahuje vysoký titr viru a virového antigenu. Většina, ne-li celá, rané cytoplazmatické fluorescence je výsledkem antigenu fagocytovaného z inokula.[60][63] Postupným vyšetřováním lze takový antigen prokázat nejprve na vnějším povrchu cytoplazmatické membrány a později v cytoplazmě, často relativně koncentrovaný v juxtanukulárním místě. Prvním jednoznačným důkazem replikace viru je výskyt rodícího se virového antigenu v jádře (obr. 2A). Alespoň v některých infikovaných buňkách se rodící se antigen dále objevuje v cytoplazmě v dostatečném množství, aby jak cytoplazma, tak jádro jasně fluoreskovaly. Infikované buňky běžně pozorované v plicích plodů, u kterých se vyvine vysoký titr protilátky pro PPV, pravděpodobně představují tuto fázi replikace (viz obr. 8C). Ovlivněné buňky se následně zaokrouhlují nahoru, stávají se pyknotickými a rozpadají se uvolňováním viru a virového antigenu (obr. 2B). Jiné buňky v kultuře, které nejsou ve vhodném stádiu pro podporu replikace viru, nadále fagocytují a akumulují virový antigen ve své cytoplazmě (obr. 2C). Druhá vlna virové replikace může být indukována, pokud jsou tyto buňky stimulovány k vstupu do S fáze buněčného cyklu, například přidáním čerstvého kultivačního média.
Hemaglutinace
PPV aglutinuje člověka, opici, morče, kočku, kuře, krysu a myš erytrocyty. Erytrocyty jiných druhů zvířat, které byly testovány, jsou relativně nebo zcela necitlivé nebo jsou výsledky nejednoznačné.[31][32][43][45][60][64] Několik parametrů hemaglutinačního (HA) testu - jako je teplota inkubace,[43][60] použitý druh erytrocytů a v případě kuřecích erytrocytů genetické složení[31][33][51] a věk[32] dárce - může kvantitativně ovlivnit výsledky. Test HA se nejčastěji provádí při pokojové teplotě, přibližně neutrálním pH a s erytrocyty morčete. Vyšší titry HA byly zaznamenány, když ředidlem použitým v testu byl spíše veronální pufr než fyziologický roztok pufrovaný fosfáty.[33] Eluci viru (hemaglutinin je součástí virionu) lze vyvolat suspendováním erytrocytů v alkalickém pufru, pH 9.[45]
Titrace infekčnosti
Titrace infekčnosti se provádějí standardním způsobem kromě toho, že protože cytopatické změny v terminálních ředěních jsou často vágní, koncové body infekčnosti se často určují buď zkoumáním buněčných kultur pro intranukleární inkluze po příslušném barvení, nebo zkoumáním buněčného kultivačního média na virový hemaglutinin.[31] Titrační postup, při kterém jsou infikované buňky evidentní pomocí IF mikroskopie[60] a stanovení plaku[65] byly také popsány.

Sérologické
Testy HI test se často používá k detekci a kvantifikaci humorální protilátky pro PPV. Protilátku lze někdy detekovat již 5 dní po vystavení prasat živému viru a může přetrvávat roky.[12] Séra vyšetřovaná HI testem jsou obvykle předčištěna tepelnou inaktivací (56 ° C, 30 minut) a adsorpcí s erytrocyty (k odstranění přirozeně se vyskytujících hemaglutininů) a kaolinem (k odstranění nebo snížení jiných než protilátek inhibujících HA).[32][60] Trypsin se také používá k odstranění neproprotilátkových inhibitorů HA.[31] Parametry HI testu byly podrobně studovány.[66][67]
SN test se příležitostně používá k detekci a kvantifikaci humorální protilátky pro PPV. Neutralizace infekčnosti je obvykle potvrzena nepřítomností nebo snížením intranukleárních inkluzí nebo fluorescenčních buněk v kulturách nebo virového hemaglutininu v kultivačním médiu.[50][60][68] Bylo zjištěno, že test SN je citlivější než test HI.[68][17] Byla popsána mikrotechnika pro aplikaci testu SN.[68]
Imunodifúze,[69] upravený přímý test fixace komplementu,[33] a enzymově vázaný imunosorbentní test[70][71] také byly úspěšně použity k detekci protilátek proti PPV.
Vývoj
Zdá se, že se tyto viry vyvinuly ~ před 120 lety s rychlým nárůstem jejich populace za posledních 40–60 let.[72] Zdá se, že se původně vyvinuli u divočáků a následně se rozšířili na domácí prasata. Rychlost vývoje byla odhadnuta na 3,86 x 10−4 - 8,23 x 10−4 náhrady za místo za rok.[73] Tato rychlost je podobná jako u ostatních jednovláknových DNA virů.
Epidemiologie
Prasečí parvovirus je všudypřítomný mezi prasaty po celém světě. V hlavních oblastech chovu prasat, jako je středozápad USA, infekce je enzootický ve většině stád a až na několik výjimek jsou prasnice imunní. Kromě toho je velká část prasniček přirozeně infikována PPV ještě před počátkem a ve výsledku si vytvoří aktivní imunitu, která pravděpodobně přetrvává po celý život. Souhrnně séroepidemiologické údaje naznačují, že expozice PPV je běžná. Zdůrazňují také vysoké riziko infekce a reprodukčních onemocnění u prasniček, u kterých se před počátkem nevyvinula imunita. Nejběžnější cestou infekce u postnatálních a prenatálních prasat jsou oronazální a transplacentární.
Prasata ošetřující imunitní matky absorbují vysoký titr protilátek pro PPV z mlezivo. Tyto titry postupně s časem klesá ředěním, jak rostou prasata, a biologickou degradací. Obvykle dosáhnou subdetekovatelných hladin za 3–6 měsíců, pokud jsou séra vyšetřena HI testem.[74][75] Někdy pasivně získané protilátky přetrvávají delší dobu. Úrovně protilátky příliš nízké na to, aby byly detekovány HI testem, mohou být detekovány SN testem.[12] Primárním významem pasivně získané protilátky je, že interferuje s vývojem aktivní imunity. Vysoké hladiny takové protilátky mohou zabránit infekci a nižší hladiny mohou minimalizovat šíření z infikovaných prasat.[76][77] Následkem toho některé skupiny prasniček nejsou plně náchylné k infekci a šíření viru, a to ani krátce před počátkem, ani během časného těhotenství.
Kontaminované prostory jsou pravděpodobně hlavními zásobníky PPV. Virus je termostabilní, odolný vůči mnoha běžným dezinfekčním prostředkům,[78] a mohou zůstat infekční měsíce v sekrecích a exkrecích z akutně infikovaných prasat. Experimentálně se ukázalo, že ačkoli prasata přenášela PPV pouze asi 2 týdny po expozici, kotce, ve kterých byla původně chována, zůstaly infekční po dobu nejméně 4 měsíců.[79] Všudypřítomnost PPV také zvyšuje možnost, že některá prasata jsou trvale infikována a alespoň periodicky vylučují virus. Vylučování mimo interval akutní infekce však nebylo prokázáno.[12] Byla navržena možnost imunotolerantních nosičů PPV v důsledku rané infekce dělohy.[50] Když byly prasničky infikovány PPV před 55. dnem březosti, jejich prasata se narodila infikovaná, ale bez protilátek. Virus byl izolován z ledvin, varlat a semenného moku takových prasat usmrcených v různých časech po narození až do věku 8 měsíců; kdy byl experiment ukončen.[17] Výsledky další studie, kde samice byly infikovány brzy v těhotenství a jejich prasata se narodila infikovaná, ale bez protilátek, také naznačují získanou imunotoleranci.[80] Byl popsán možný příklad infikovaného, imunotolerantního, sexuálně aktivního kance.[12]
Kanci mohou hrát v kritické době významnou roli při šíření PPV. Během akutní infekce je virus vylučován různými způsoby, včetně sperma a byla hlášena izolace PPV ze spermatu přirozeně infikovaných kanců.[4][31][81] Sperma může být kontaminována zvenčí, například výkaly obsahujícími virus nebo v mužském reprodukčním traktu. Virus byl izolován z varlat kance 5 dní po injekci do kance předkožka[82] a ze varlat kanců zabitých 5 a 8 dní poté, co byli infikováni orálně (Mengeling, nepublikovaná data 1976). Virus byl také izolován z skrotálních lymfatických uzlin kanců usmrcených 5, 8, 15, 21 a 35 dní po oronazální expozici. Po 8. dni byla izolace provedena kokultivací fragmentů lymfatických uzlin s fetálními prasečími ledvinovými buňkami (Mengeling, nepublikovaná data 1976). Bez ohledu na jejich imunitní stav mohou kanci také fungovat jako prostředek k mechanickému šíření PPV u vnímavých žen.
Patogeneze
Damy jsou náchylné k reprodukčnímu selhání vyvolanému PPV, pokud jsou infikovány kdykoli během přibližně první poloviny těhotenství. Tento interval mateřské citlivosti je indikován kolektivními výsledky několika experimentálních studií,[15][16][83][84] hloubkovým epidemiologickým vyšetřováním,[85][86] a odhady doby úmrtí plodů shromážděné během epidemiologických průzkumů.[5][8] Důsledky infekce matek během tohoto intervalu jsou embryonální a fetální smrt následovaná resorpcí a mumifikací. Transplacentární infekce také následuje po expozici matky po midgestaci, ale plody obvykle přežívají bez zjevných klinických účinků v děloze. Pravděpodobným důvodem je, že transplacentární infekce často vyžaduje 10–14 dní[84][87] nebo déle,[15] a do 70 dnů těhotenství je většina plodů schopna vyvinout ochrannou imunologickou odpověď na virus. Obecně platí, že plody experimentálně infikované transuterinní inokulací viru uhynuly, když byly infikovány před 70. dnem gestace, ale přežily a produkovaly protilátky, když byly infikovány později v gestaci.[63][88][89][90] Rovněž byl popsán kmen PPV s mírně vyšší virulencí.[91] Obvyklé důsledky infekce v různých fázích těhotenství jsou shrnuty v stůl 1.
Když je transplacentálně infikována pouze část vrhu, jak je tomu často, jeden nebo více kamarádů z vrhu je často infikováno následným intrauterinním šířením viru. Totéž by platilo, kdyby počáteční infekce byla kontaminovaným spermatem. Výsledkem je jakákoli kombinace nebo všechny následky uvedené v stůl 1 se mohou vyvíjet ve stejném vrhu. Intrauterinní diseminace je pravděpodobně méně častá, když jsou infikována časná embrya, protože jsou po smrti rychle resorbována, což účinně odstraňuje nitroděložní rezervoár viru.[84] V takových případech nejsou při porodu žádné důkazy o příčině méně prasat na vrh.
| Interval těhotenství (dny)A | |||
|---|---|---|---|
| Infekce přehrady | Infekce Conceptusb | Popis Conceptus | Důsledky infekce |
| ≤56 | 10–30 | Embryo | Smrt a resorpce |
| 30–70 | Plod | Smrt a mumifikace | |
| >56 | 70 období | Plod | Imunitní odpověď a obvykle přežití in utero |
AIntervaly jsou přibližné.
bZa předpokladu transplacentárních infekcí 10–14 dní po expozici matky.
Účinek PPV na vajíčko před ovulací, pokud existuje, není znám. Virus se houževnatě drží na vnějším povrchu zona pellucida oplodněného vajíčka prasete,[92][93] a ačkoli to zjevně nemůže proniknout do této vrstvy, spekuluje se, že by to mohlo představovat hrozbu pro embryo po vylíhnutí.[92]
Přes silné nepřímé důkazy[80] přímá příčinná role spermatu kontaminovaného PPV při reprodukčním selhání nebyla jednoznačně stanovena.[82] Zona pellucida by mohla chránit časné embryo, zatímco se vyvíjí lokální imunita. Virus může naopak způsobit děložní změny nekompatibilní s těhotenstvím.[94] V každém případě žena infikovaná spermatem poskytuje infekci ostatním.
S možnou výjimkou děložních změn zmíněných v předchozím odstavci je reprodukční selhání vyvolané PPV způsobeno přímým účinkem viru na koncept. Při absenci imunitní odpovědi se virus extenzivně replikuje v těchto tkáních. V době, kdy conceptus umírá, obsahuje většina jeho buněk velké množství intracytoplazmatického virového antigenu, což lze prokázat pomocí mikroskopie IF. Relativní nedostatek jaderné fluorescence v době smrti ve srovnání s dřívějšími stadii onemocnění naznačuje, že když je konceptus vážně zasažen, mitotická aktivita a související podmínky nezbytné pro virovou replikaci jsou potlačeny více než fagocytární aktivita.
Smrt pojetí pravděpodobně vyplývá z kolektivního poškození viru v různých tkáních a orgánech, včetně placenty.[90] Při absenci imunitní odpovědi jsou však změny v téměř jakémkoli životně důležitém orgánu pravděpodobně dostatečné k tomu, aby nakonec způsobily smrt. Jedním z nejvýraznějších rysů distribuce virů je rozsáhlé zapojení endotelu. To zřejmě vylučuje další rozvoj vaskulární sítě konceptu. Příprava na buněčnou mitózu (tj. Fázi S) vede k souběžné replikaci viru a buněčné smrti. Poškození oběhového systému plodu je indikováno otoky, krvácením a hromaděním velkého množství serosangvinálních tekutin v tělních dutinách. Mikroskopicky je patrná nekróza endotelu.[95]
Mechanismus transplacentární infekce byl zkoumán pomocí IF mikroskopie k identifikaci infikovaných buněk v mateřských a plodových tkáních v postupně delších intervalech po expozici matky nebo novorozence.[87] Vyšetřování tkání sousedících s mateřsko-fetálním spojením odhalilo virový antigen v endoteliálních a mezenchymálních buňkách chorionu se zvyšujícím se zapojením těchto tkání v pozdějších fázích těhotenství. Virový antigen nebyl nikdy jednoznačně detekován ani v děložním epitelu, ani v trophectodermu. V důsledku toho neexistoval žádný důkaz o mateřském přenosu viru replikací přes tyto tkáně. Tuto cestu však nelze vyloučit, protože byla zkoumána pouze malá část celkové kontaktní plochy. Byl zvážen přenos viru do makrofágů.[96] Ať už je cesta jakákoli, virémie matky se zdá být pravděpodobným předpokladem pro transplacentární infekci.[15][16]
Léze
U negravidních prasat nebyly hlášeny ani makroskopické ani mikroskopické léze.[13][20] Je možné, že buněčné infiltrace následně popsané pro plody mohou být indukovány infekcí během perinatálního intervalu.
Makroskopické léze nebyly u těhotných matek hlášeny; mikroskopické léze však byly pozorovány v tkáních prasniček zabitých poté, co byly jejich plody infikovány transuterinní inokulací viru. Gilty, které byly séronegativní, když byly jejich plody infikovány v 70. dnu těhotenství, měly fokální akumulaci mononukleárních buněk přiléhajících k endometriu a v hlubších vrstvách lamina propria, když byly zabity o 12 a 21 dní později. Kromě toho byly perivaskulární manžety plazmatických buněk a lymfocytů v mozku, míchě a očních cév.[97] Když byly plody infikovány dříve v těhotenství (35, 50 a 60 dní) a jejich matky byly usmrceny o 7 a 11 dní později, léze byly podobné. Léze dělohy však byly závažnější a zahrnovaly také rozsáhlou manžetu myometriálních a endometriálních cév s mononukleárními buňkami.[95] Pouze ohniskové akumulace lymfocytů byly pozorovány v dělohách prasniček, které byly séropozitivní, když byly infikovány jejich plody.[90]
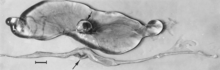
Makroskopické změny embryí jsou smrt následovaná resorpcí tekutin (obr. 4) a poté měkkými tkáněmi (obr. 5). Virus a virový antigen jsou široce distribuovány v tkáních infikovaných embryí a jejich placent,[84] a je pravděpodobné, že mikroskopické léze nekrózy a poškození cév, následně popsané pro plody, se také vyvinou v pokročilých embryích.
U plodů infikovaných dříve, než se stanou imunokompetentními, existuje řada makroskopických změn (obr. 6). Patří mezi ně proměnlivý stupeň zakrnění a někdy zjevná ztráta stavu, než jsou patrné další vnější změny; příležitostně zvýšená důležitost krevních cév nad povrchem plodu v důsledku přetížení a úniku krve do sousedících tkání; překrvení, otoky a krvácení s akumulací serosangvinálních tekutin v tělních dutinách; hemoragické zabarvení se po smrti postupně stmívá; a dehydratace (mumifikace). Mnoho z těchto změn platí i pro placentu. Mikroskopické léze sestávají primárně z rozsáhlé buněčné nekrózy v široké škále tkání a orgánů[95][98] (Obr. 7A). Zánět[98] a intranukleární inkluze[95] byly také popsány.

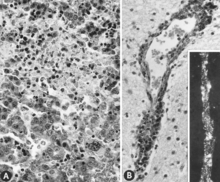
Naproti tomu u plodů infikovaných poté, co se stanou imunokompetentními pro PPV, nebyly hlášeny makroskopické změny. Mikroskopické léze jsou primárně hypertrofie endotelu[97] a infiltrace mononukleárních buněk v souladu s imunitní odpovědí.[97][98] Meningoencefalitida charakterizovaná perivaskulární manžetou s proliferujícími adventitiálními buňkami, histiocyty a několika plazmatickými buňkami byla pozorována v šedé a bílé hmotě mozku a v leptomeningech PPV infikovaných mrtvých prasat. Předpokládalo se, že tyto léze jsou patognomické pro PPV infekci.[24] Podobné léze byly pozorovány u živých plodů infikovaných PPV pozdě v těhotenství[97][98] (Obr. 7B).
U plodů infikovaných téměř po požití se mohou vyvinout oba obecné typy mikroskopických lézí (tj. Nekróza a infiltrace mononukleárních buněk).[95] když imunitní odpověď není dostatečná k zajištění ochrany.
Diagnóza
PPV je třeba brát v úvahu při diferenciální diagnostice reprodukčního selhání prasat, kdykoli existuje důkaz o embryonální nebo fetální smrti nebo obojí. Byly popsány patologické následky infekce matky během těhotenství (viz část o klinických známkách). Pokud jsou postiženy prasničky, ale ne prasnice, není během těhotenství pozorováno onemocnění matky, existuje jen málo potratů nebo žádné potraty nebo vývojové anomálie plodu a další důkazy naznačují infekční onemocnění, pak lze provést předběžnou diagnózu reprodukčního selhání vyvolaného PPV. Relativní nedostatek mateřských onemocnění, potratů a vývojových anomálií plodu odlišuje PPV od většiny ostatních infekčních příčin reprodukčního selhání. Definitivní diagnóza však vyžaduje laboratorní podporu.
Několik mumifikovaných plodů (o délce <16 cm) nebo plic z těchto plodů, pokud jsou dostatečně vyvinuté, by mělo být odesláno do diagnostické laboratoře. Větší mumifikované plody (tj. Více než 70 dnů gestačního věku),[99] mrtvě narozená prasata a novorozená prasata se nedoporučují k podání, pokud nejsou jedinými dostupnými vzorky. Pokud jsou infikovány, jejich tkáně obvykle obsahují protilátky, které interferují s laboratorními testy na virus nebo virový antigen.

Pokud se ženám nepodaří porodit, přestože jsou v anestezii a jsou poslány na jatka, měly by být jejich dělohy odebrány a vyšetřeny na postižené plody. Někdy pouze zbytky tkání plodu zůstanou, když plody umírají brzy ve střední třetině těhotenství. Přesto se jedná o adekvátní vzorky, pokud jsou testovány na virový antigen pomocí mikroskopie IF.[5][63] Absence postižených plodů nebo zbytků plodu nevylučuje reprodukční selhání vyvolané PPV. Když všechna embrya z vrhu zemřou a jsou úplně resorbována po prvních několika týdnech březosti, může samice zůstat endokrinologicky březá a vrátit se do říje až po očekávané době porodu.[100]
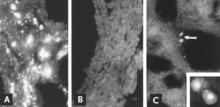
Identifikace virového antigenu pomocí mikroskopie IF je spolehlivý a citlivý diagnostický postup. Řezy fetálních tkání se připraví pomocí kryostatového mikrotomu a poté se reagují se standardizovanými činidly.[5][26] Test lze dokončit během několika hodin. Při absenci fetální protilátkové odpovědi je antigen pozorován ve fetálních tkáních (obr. 8A, B); i když je protilátka přítomna, infikované buňky lze obvykle detekovat ve fetálních plicích (obr. 8C).
Jako diagnostická technika byla rovněž doporučena detekce virového hemaglutininu.[101][102] Tkáně se triturují v ředidle a poté se sedimentují centrifugací. Supernatantová kapalina je testována na aglutinační aktivitu pro morčací erytrocyty. Tento test vyžaduje minimum laboratorního vybavení a je účinný v nepřítomnosti protilátek.
Izolace viru je méně vhodná jako běžný diagnostický postup než kterýkoli z výše uvedených testů. Infekčnost se pomalu, ale postupně ztrácí po smrti plodu;[63] v důsledku toho je izolace viru z mumifikovaných plodů, které uhynuly v důsledku infekce, někdy neúspěšná.[5] Tento postup je navíc časově náročný a kontaminace představuje trvalou hrozbu kvůli stabilitě PPV v laboratoři[31] a protože buněčné kultury se někdy nevědomky připravují z infikovaných tkání.[31][41][53][54][55] Mikroskopie IF se často používá k určení, zda byl PPV izolován v buněčné kultuře.[5][50][103]
Obecně se sérologické postupy pro diagnostiku doporučují pouze v případě, že tkáně mumifikovaných plodů nejsou k dispozici pro testování, jak bylo popsáno výše. Výsledky s mateřským sérem jsou cenné, pokud není detekována protilátka, čímž je vyloučena PPV jako příčina, a pokud vzorky odebrané v intervalech odhalí sérokonverzi PPV shodnou s reprodukčním selháním.[23][26][100] Protože PPV je všudypřítomný, je přítomnost protilátky v jediném vzorku jinak bezvýznamná. Stanovení relativního množství protilátky přítomné jako imunoglobulin M a G však může naznačovat aktuálnost infekce.[66][69] Detekce protilátek v séru plodů a mrtvě narozených prasat a v séru odebraném z novorozených prasat před ošetřením je důkazem infekce in utero, protože mateřská protilátka nepřekračuje spojení matky a plodu.[11][60][17][80][104] Pokud sérum není k dispozici, byly k prokázání protilátky úspěšně použity tělní tekutiny odebrané z plodů nebo jejich vnitřností, které byly uchovávány v plastovém vaku přes noc při 4 ° C.[101][105]
Léčba a prevence
Neexistuje žádná léčba reprodukčního selhání vyvolaného PPV.
Prasničky by měly být před chovem buď přirozeně infikovány PPV, nebo očkovány proti PPV. Pro podporu přirozené infekce je běžnou praxí zajistit kontakt mezi séronegativními prasničkami a séropozitivními prasnicemi s očekáváním, že jedna nebo více prasnic bude vylučovat virus. Moving gilts to a potentially contaminated area, either currently or recently inhabited by seropositive swine, also can be recommended. Once infection is started, the virus spreads rapidly among fully susceptible swine. Just how effective these procedures are in increasing the incidence of natural infection is unknown. For whatever reasons, infection is common, and probably well over one-half of all gilts in areas where PPV is enzootic are infected before they are bred for the first time.[60]
Použití vakcína is the only way to ensure that gilts develop active immunity before conception. Both inactivated[76][106][107][108][109][110][111][112] and modified live-virus (MLV) vaccines[113][114] byly vyvinuty. An inactivated vaccine has been tested under field conditions,[109][115] and both types of vaccines were effective when tested under controlled laboratory conditions.[111][112][113]
Vaccines should be administered several weeks before conception to provide immunity throughout the susceptible period of gestation but after the disappearance of passively acquired colostral antibody, which could interfere with the development of active immunity.[116] These limits may define a very brief interval for effective vaccination of gilts that are bred before 7 months of age. Although inactivated vaccine provides maximum safety, there is experimental evidence that PPV can be sufficiently attenuated so that it is unlikely to cause reproductive failure even if inadvertently administered during gestation.[113] The apparent safety of MLV vaccine may be due to its reduced ability to replicate in tissues of the intact host and cause the level of viremia needed for transplacental infection.[117] Moreover, it has been shown by transuterine inoculation of both virulent and attenuated virus that a much larger dose of attenuated virus is required to establish infection of fetuses.[118] Duration of immunity following vaccination is unknown; however, in one study antibody titers were maintained for at least 4 months after administration of an inactivated vaccine.[107] Low levels of antibody found to be protective allow speculation that, once the immune system has been primed with PPV, subsequent exposure to virulent virus during gestation is unlikely to result in transplacental infection even if antibody from vaccination is no longer detected.[111]
Vaccination is recommended also for seronegative sows and boars. Seronegative sows are usually found only in PPV-free herds; in such cases, inactivated vaccine is indicated. Experience has shown that few herds can be expected to remain free of PPV even if access is carefully controlled. Introduction of PPV into a totally susceptible herd can be disastrous.[85] Vaccination of boars should reduce their involvement in dissemination of the virus.
Vaccines are used extensively in the United States and in several other countries where PPV has been recognized as an economically important cause of reproductive failure. All federally licensed vaccines marketed in the United States are inactivated.
Viz také
Reference
- ^ "Rod: Protoparvovirus". Mezinárodní výbor pro taxonomii virů (ICTV). Citováno 8. ledna 2019.
- ^ „Historie taxonomie ICTV: Ungulate protoparvovirus 1". Mezinárodní výbor pro taxonomii virů (ICTV). Citováno 9. ledna 2019.
- ^ „10. zpráva ICTV (2018)“.
- ^ A b C Cartwright, S. F. & Huck, R. A. (1967). "Viruses isolated in association with herd infertility, abortions and stillbirths in pigs". Vet Rec. 81: 196–197.
- ^ A b C d E F G Mengeling, W. L, WL (1978b). "Prevalence of porcine parvovirus-induced reproductive failure: An abattoir study". J Am Vet Med Assoc. 172 (11): 1291–1294. PMID 659307.
- ^ Thacker, B. & Leman, A. D. (1978). "Evaluation of gravid uteri at slaughter for porcine parvovirus infection". Proc Int Congr Pig Vet Soc. 5: M–49.
- ^ Vannier, P. & Tillon, J. P. (1979). "Diagnostic de certitude de l'infection à parvovirus dans les troubles de la reproduction de l'espèce porcine". Rec Med Vet. 155: 151–158.
- ^ A b Mengeling, William L; Lager, Kelly M; Zimmerman, Jeffery K; Samarikermani, Nader; Beran, George W (2016). "A Current Assessment of the Role of Porcine Parvovirus as a Cause of Fetal Porcine Death". Journal of Veterinary Diagnostic Investigation. 3 (1): 33–5. doi:10.1177/104063879100300107. PMID 1645596.
- ^ Krakowka, S; Ellis, J. A.; Meehan, B; Kennedy, S; McNeilly, F; Allan, G (2016). "Viral Wasting Syndrome of Swine: Experimental Reproduction of Postweaning Multisystemic Wasting Syndrome in Gnotobiotic Swine by Coinfection with Porcine Circovirus 2 and Porcine Parvovirus". Veterinární patologie. 37 (3): 254–63. doi:10.1354/vp.37-3-254. PMID 10810990.
- ^ Opriessnig, T; Fenaux, M; Yu, S; Evans, R.B.; Cavanaugh, D; Gallup, J.M.; Pallares, F.J.; Thacker, E.L.; Lager, K.M.; Meng, X.J.; Halbur, P.G. (2004). "Effect of porcine parvovirus vaccination on the development of PMWS in segregated early weaned pigs coinfected with type 2 porcine circovirus and porcine parvovirus". Veterinární mikrobiologie. 98 (3–4): 209–20. doi:10.1016/j.vetmic.2003.11.006. PMID 15036529.
- ^ A b C d Johnson, R. H. & Collings, D. F. (1969). "Experimental infection of piglets and pregnant gilts with a parvovirus". Vet Rec. 85 (16): 446–447. doi:10.1136/vr.85.16.446. PMID 5387900.
- ^ A b C d E F Johnson, R. H.; Donaldson-Wood, C. R.; Joo, H. S. & Allender, U (1976). "Observations on the epidemiology of porcine parvovirus". Aust Vet J. 52 (2): 80–84. doi:10.1111/j.1751-0813.1976.tb13862.x. PMID 985234.
- ^ A b C d Cutlip, R. C. & Mengeling, W. L. (1975a). "Experimentally induced infection of neonatal swine with porcine parvovirus". Am J Vet Res. 36 (8): 1179–1182. PMID 1098530.
- ^ A b Fujisaki, Y.; Morimoto, T .; Sugimori, T. & Suziki, H. (1975). "Experimental infection of pigs with porcine parvovirus". Natl Inst Anim Health Q (Tokyo). 22: 205–206.
- ^ A b C d E Joo, H. S.; Donaldson-Wood, C. R. & Johnson, R. H. (1976a). "Observations on the pathogenesis of porcine parvovirus infection". Arch Virol. 51 (1–2): 123–129. doi:10.1007/BF01317841. PMID 986801.
- ^ A b C d Mengeling, W. L. & Cutlip, R. C. (1976). "Reproductive disease experimentally induced by exposing pregnant gilts to porcine parvovirus". Am J Vet Res. 37 (12): 1393–1400. PMID 999067.
- ^ A b C d Johnson, R. H.; Collings, D. F. (1971). "Transplacental infection of piglets with a porcine parvovirus". Research in Veterinary Science. 12 (6): 570–2. doi:10.1016/s0034-5288(18)34111-0. PMID 5169329.
- ^ Dea, S.; Elazhary, M. A. S. Y.; Martineau, G. P. & Vaillancourt, J. (1985). "Parvovirus-like particles associated with diarrhea in unweaned piglets". Can J Comp Med. 49 (3): 343–345. PMC 1236185. PMID 2412678.
- ^ Yasuhara, H.; Matsui, O.; Hirahara, T.; Ohgtani, T.; Tanaka, M. L.; Kodama, K .; Nakai, M. & Sasaki, N. (1989). "Characterization of parvovirus isolated from diarrheic feces of a pig". Jpn J Vet Sci. 51 (2): 337–344. doi:10.1292/jvms1939.51.337. PMID 2544760.
- ^ A b Brown, T. T. Jr.; Paul, P. S. & Mengeling, W. L. (1980). "Response of conventionally raised weanling pigs to experimental infection with a virulent strain of porcine parvovirus". Am J Vet Res. 41 (8): 1221–1224. PMID 7447115.
- ^ Kresse, J. I.; Taylor, W. D.; Stewart, W. C. & Eernisse, K. A. (1985). "Parvovirus infection in pigs with necrotic and vesicle- like lesions". Vet Microbiol. 10 (6): 525–531. doi:10.1016/0378-1135(85)90061-6. PMID 3006323.
- ^ Johnson, R. H, RH (1969). "A search for Parvoviridae (Picornaviridae)". Vet Rec. 84 (1): 19–20. doi:10.1136/vr.84.1.19. PMID 5812965.
- ^ A b Morimoto, T .; Kurogi, H .; Miura, Y .; Sugimori, T. & Fujisaki, Y. (1972b). "Isolation of Japanese encephalitis virus and a hemagglutinating DNA virus from the brain of stillborn piglets". Natl Inst Anim Health Q (Tokyo). 12: 127–136.
- ^ A b C Narita, M .; Inui, S .; Kawakami, Y.; Kitamura, K. & Maeda, A. (1975). "Histopathological changes of the brain in swine fetuses naturally infected with porcine parvovirus". Natl Inst Anim Health Q (Tokyo). 15: 24–28.
- ^ Forman, A. J.; Lenghaus, C.; Hogg, G. G. & Hale, C. J. (1977). "Association of a parvovirus with an outbreak of foetal death and mummification in pigs". Aust Vet J. 53 (7): 326–329. doi:10.1111/j.1751-0813.1977.tb00241.x. PMID 921639.
- ^ A b C d Mengeling, W. L.; Cutlip, R. C.; Wilson, R. A .; Parks, J. B. & Marshall, R. F. (1975). "Fetal mummification associated with porcine parvovirus infection". J Am Vet Med Assoc. 166 (10): 993–995. PMID 1126862.
- ^ Biront, P. & Bonte, P. (1983). "Porcine parvovirus (P.P.V.) infection in boars. I. Possibility of a genital localization in the boar after oronasal infection". Zentralblatt für Veterinärmedizin. Reihe B. 30 (7): 541–545. doi:10.1111/j.1439-0450.1983.tb01879.x. PMID 6316695.
- ^ Thacker, B. J.; Joo, H. S.; Winkelman, N. L.; Leman, A. D. & Barnes, D. M (1987). "Clinical, virologic, and histopathologic observations of induced porcine parvovirus infection in boars". Am J Vet Res. 48 (5): 763–767. PMID 3035971.
- ^ A b Siegl, Günter (1976). The Parvoviruses (1. vyd.). Vienna, Austria: Springer-Verlag.
- ^ Bachmann, Peter A; Hoggan, David; Kurstak, Edouard; Melnick, Joseph L; Pereira, Helio G; Tattersall, Peter; Vago, Constant (1979). "Parvoviridae: Second Report". Intervirologie. 11 (4): 248–54. doi:10.1159/000149041. PMID 372134.
- ^ A b C d E F G h i j k l m n Cartwright, S. F.; Lucas, M. & Huck, R. A (1969). "A small haemagglutinating porcine DNA virus. I. Isolation and properties". J Comp Pathol. 79 (3): 371–377. doi:10.1016/0021-9975(69)90053-X. PMID 4899939.
- ^ A b C d Morimoto, T .; Fujisaki, Y.; Ito, Y. & Tanaka, Y. (1972a). "Biological and physiochemical properties of porcine parvovirus recovered from stillborn piglets". Natl Inst Anim Health Q (Tokyo). 12: 137–144.
- ^ A b C d Ruckerbauer, G. M.; Dulac, G. C. & Boulanger, P (1978). "Demonstration of parvovirus in Canadian swine and antigenic relationships with isolates from other countries". Can J Comp Med. 42 (3): 278–285. PMC 1277639. PMID 356941.
- ^ Cotmore, S. F.; Sturzenbecker, L. J. & Tattersall, P (1983). "The autonomous parvovirus MVM encodes two nonstructural proteins in addition to its capsid polypeptides". Virologie. 129 (2): 333–343. doi:10.1016/0042-6822(83)90172-1. PMID 6623929.
- ^ Mengeling, W. L.; Paul, P. S.; Bunn, T. O.; Ridpath, J. F. (1986). "Antigenic Relationships among Autonomous Parvoviruses". Journal of General Virology. 67 (12): 2839–44. doi:10.1099/0022-1317-67-12-2839. PMID 2432167.
- ^ Mengeling, W. L.; Ridpath, J. F.; Vorwald, A. C. (1988). "Size and Antigenic Comparisons among the Structural Proteins of Selected Autonomous Parvoviruses". Journal of General Virology. 69 (4): 825–37. doi:10.1099/0022-1317-69-4-825. PMID 3356979.
- ^ Molitor, T. W.; Joo, H. S. & Collect, M. S. (1983). "Porcine parvovirus: virus purification and structural and antigenic properties of virion polypeptides". J Virol. 45 (2): 842–854. PMC 256478. PMID 6834473.
- ^ Berns, Kenneth I. (1984). The Parvoviruses. New York: Plenum Press.
- ^ Rondhuis, P. R. & Straver, P. J. (1972). "Enige kenmerken van een klien, hemagglutinerend DNA-virus, geisoleer uit een verworpen varkensfoetus". Tijdschr Diergeneeskd. 97: 1257–1267.
- ^ A b C Lucas, M. H. & Napthine, P. (1971). "Fluorescent antibody technique in the study of three porcine viruses: Transmissible gastroenteritis virus, vomiting and wasting disease virus, and the parvovirus 59e/63". J Comp Pathol. 81 (1): 111–117. doi:10.1016/0021-9975(71)90062-4. PMID 4933149.
- ^ A b C d Mengeling, W. L, WL (1975). "Porcine parvovirus: Frequency of naturally occurring transplacental infection and viral contamination of fetal porcine kidney cell cultures". Am J Vet Res. 36 (1): 41–44. PMID 163603.
- ^ Pirtle, E. C, EC (1974). "Titration of two porcine respiratory viruses in mammalian cell cultures by direct fluorescent antibody staining". Am J Vet Res. 35 (2): 249–250. PMID 4591612.
- ^ A b C Mayr, A .; Bachmann, P. A.; Siegl, G.; Mahnel, H. & Sheffy, B. E (1968). "Characterization of a small porcine DNA virus". Arch Gesamte Virusforsch. 25 (1): 38–51. doi:10.1007/BF01243088. PMID 5729634.
- ^ Bachmann, P. A, PA (1972). "Porcine parvovirus infection in vitro: A study model for the replication of parvoviruses. I. Replication at different temperatures". Proc Soc Exp Biol Med. 140 (4): 1369–1374. doi:10.3181/00379727-140-36676. PMID 5066576.
- ^ A b C Hallauer, C.; Siegl, G. & Kronauer, G. (1972). "Parvoviruses as contaminants of permanent human cell lines. III. Biological properties of the isolated viruses". Arch Gesamte Virusforsch. 38 (4): 369–382. doi:10.1007/bf01262827. PMID 5083410.
- ^ Tennant, R. W, RW (1971). "Inhibition of Mitosis and Macromolecular Synthesis in Rat Embryo Cells by Kilham Rat Virus". J Virol. 8 (4): 402–408. PMC 376213. PMID 5167023.
- ^ Siegl, G. & Gautschi, M. (1973a). "The multiplication of parvovirus Lu III in a synchronized culture system. I. Optimum conditions for virus replication". Arch Gesamte Virusforsch. 40 (1): 105–118. doi:10.1007/bf01242642. PMID 4571169.
- ^ Siegl, G. & Gautschi, M. (1973b). "The multiplication of parvovirus Lu III in a synchronized culture system. II. Biochemical characteristics of virus replication". Arch Gesamte Virusforsch. 40 (1): 119–127. doi:10.1007/bf01242643. PMID 4266337.
- ^ Coackley, W. & Smith, V. W. (1972). "Porcine parvoviruses in Western Australia". Aust Vet J. 48 (9): 536. doi:10.1111/j.1751-0813.1972.tb02330.x. PMID 4651130.
- ^ A b C d Johnson, R. H. (1973). "Isolation of swine parvovirus in Queensland". Aust Vet J. 49 (3): 257–259. doi:10.1111/j.1751-0813.1973.tb06768.x. PMID 4574965.
- ^ A b Pini, A, A (1975). "Porcine parvovirus in pig herds in southern Africa". J S Afr Vet Assoc. 46 (3): 241–244. PMID 1219104.
- ^ Joo, H. S.; Donaldson-Wood, C. R.; Johnson, R. H. & Watson, D. L (1976d). "Antibody to porcine, feline and rat parvoviruses in various animal species". Res Vet Sci. 21 (1): 112–113. doi:10.1016/S0034-5288(18)33407-6. PMID 951520.
- ^ A b Huygelen, C. & Peetermans, J. (1967). "Isolation of a hemagglutinating picornavirus from a primary swine kidney cell culture". Arch Gesamte Virusforsch. 20 (2): 260–262. doi:10.1007/BF01241281. PMID 5598013.
- ^ A b Bachmann, P. A. (1969). "Vorkommen und Verbreitung von Picodna (Parvo)—Virus beim Schwein". Zentralbl. Veterinarmed. B. 16 (4): 341–345. doi:10.1111/j.1439-0450.1969.tb00118.x. PMID 5816005.
- ^ A b Hafez, S. M. & Liess, B. (1979). "Isolation of parvovirus from kidney cell cultures of gnotobiotic piglets". Zentralbl. Veterinarmed. B. 26 (10): 820–827. doi:10.1111/j.1439-0450.1979.tb00793.x. PMID 394537.
- ^ Hallauer, C.; Kronauer, G. & Siegl, G (1971). "Parvovirus as contaminants of permanent human cell lines. I. Virus isolations from 1960–1970". Arch Gesamte Virusforsch. 35 (1): 80–90. doi:10.1007/bf01249755. PMID 5167103.
- ^ Croghan, D. L. & Matchett, A. (1973). "b-propiolactone sterilization of commercial trypsin". Appl Microbiol. 26 (5): 832. PMC 379912. PMID 4586933.
- ^ Croghan, D. L.; Matchett, A. & Koski, T. A (1973). "Isolation of porcine parvovirus from commercial trypsin". Appl Microbiol. 26 (3): 431–433. PMC 379810. PMID 4584585.
- ^ Mengeling, W. L, WL (1978a). "Elimination of porcine parvovirus from infected cell cultures by inclusion of homologous antiserum in the nutrient medium". Am J Vet Res. 39 (2): 323–324. PMID 629467.
- ^ A b C d E F G h i j Mengeling, W. L, WL (1972). "Porcine parvovirus: Properties and prevalence of a strain isolated in the United States". Am J Vet Res. 33 (11): 2239–2248. PMID 4628211.
- ^ Siegl, G.; Hallauer, C. & Novak, A (1972). "Parvoviruses as contaminants of permanent human cell lines. IV. Multiplication of KBSH-virus in KB-cells". Arch Gesamte Virusforsch. 36 (3): 351–62. doi:10.1007/BF01249866. PMID 4112026.
- ^ Bachmann, P. A., PA; Danner, K (1976). "Porcine parvovirus infection in vitro: A study model for the replication of parvoviruses. II. Kinetics of virus and antigen production". Zentralbl. Veterinarmed. B. 23 (5–6): 355–363. PMID 986740.
- ^ A b C d Mengeling, W. L. & Cutlip, R. C. (1975). "Pathogenesis of in utero infection: Experimental infection of 5-week-old porcine fetuses with porcine parvovirus". Am J Vet Res. 36 (8): 1173–1177. PMID 1098529.
- ^ Darbyshire, J. H. & Roberts, D. H. (1968). "Some respiratory virus and mycoplasma infections of animals". J Clin Pathol. 21 (Suppl 2): 61–92.
- ^ Kawamura, H .; Fujita, T. & Imada, T. (1988). "Plaque formation and replication of porcine parvovirus in embryonic swine kidney cell line, ESK cells". Jpn J Vet Sci. 50 (3): 803–808. doi:10.1292/jvms1939.50.803. PMID 3210492.
- ^ A b Kim, Y. H. (1974). "Studies on hemagglutination and hemagglutination- inhibition reaction of porcine parvovirus". Bull AZABU Vet Coll. 27: 61–65.
- ^ Joo, H. S.; Donaldson-Wood, C. R.; Johnson, R. H. (1976). "A Standardised Haemagglutination Inhibition Test for Porcine Parvovirus Antibody". Australský veterinární věstník. 52 (9): 422–4. doi:10.1111/j.1751-0813.1976.tb09517.x. PMID 1016168.
- ^ A b C Joo, H. S.; Donaldson-Wood, C. R.; Johnson, R. H. (1975). "A microneutralization test for the assay of porcine parvovirus antibody". Archives of Virology. 47 (4): 337–41. doi:10.1007/BF01347974. PMID 1169929.
- ^ A b Joo, H. S.; Johnson, R. H.; Watson, D. L. (1978). "Serological Procedures to Determine Time of Infection of Pigs with Porcine Parvovirus". Australský veterinární věstník. 54 (3): 125–7. doi:10.1111/j.1751-0813.1978.tb05524.x. PMID 687263.
- ^ Hohdatsu, T; Baba, K; Ide, S; Tsuchimoto, M; Nagano, H; Yamagami, T; Yamagishi, H; Fujisaki, Y; Matumoto, M (1988). "Detection of antibodies against porcine parvovirus in swine sera by enzyme-linked immunosorbent assay". Veterinární mikrobiologie. 17 (1): 11–9. doi:10.1016/0378-1135(88)90075-2. PMID 2845632.
- ^ Westenbrink, F; Veldhuis, M.A.; Brinkhof, J.M.A (1989). "An enzyme-linked immunosorbent assay for detection of antibodies to porcine parvovirus". Journal of Virological Methods. 23 (2): 169–78. doi:10.1016/0166-0934(89)90130-4. PMID 2542351.
- ^ Cadar, Dániel; Dán, Ádám; Tombácz, Kata; Lőrincz, Márta; Kiss, Timea; Becskei, Zsolt; Spînu, Marina; Tuboly, Tamás; Cságola, Attila (2012). "Phylogeny and evolutionary genetics of porcine parvovirus in wild boars". Infekce, genetika a evoluce. 12 (6): 1163–71. doi:10.1016/j.meegid.2012.04.020. PMID 22575819.
- ^ Cadar, Dániel; Cságola, Attila; Kiss, Timea; Tuboly, Tamás (2013). "Capsid protein evolution and comparative phylogeny of novel porcine parvoviruses". Molekulární fylogenetika a evoluce. 66 (1): 243–53. doi:10.1016/j.ympev.2012.09.030. PMID 23044400.
- ^ Etoh, M.; Morishita, E. & Watanabe, Y. (1979). "Transitional antibodies and spontaneous infection in porcine parvovirus infection". Jpn J Swine Husb Res. 16: 237–239.
- ^ Paul, P. S.; Mengeling, W. L. & Pirtle, E. C. (1982). "Duration and biological half-life of passively acquired colostral antibodies to porcine parvovirus". Am J Vet Res. 43 (8): 1376–1379. PMID 7103222.
- ^ A b Suzuki, H. & Fujisaki, Y (1976). "Immunizing effects of inactivated porcine parvovirus vaccine on piglets". Natl Inst Anim Health Q (Tokyo). 16: 81.
- ^ Paul, P. S.; Mengeling, W. L. & Brown, T. T. Jr (1980). "Effect of vaccinal and passive immunity on experimental infection of pigs with porcine parvovirus". Am J Vet Res. 41 (9): 1368–1371. PMID 7447129.
- ^ Brown, T. T. Jr, TT (1981). "Laboratory evaluation of selected disinfectants as virucidal agents against porcine parvovirus, pseudorabies virus, and transmissible gastroenteritis virus". Am J Vet Res. 42 (6): 1033–1036. PMID 6269467.
- ^ Mengeling, W. L. & Paul, P. S. (1986). "The relative importance of swine and contaminated premises as reservoirs of porcine parvovirus". J Am Vet Med Assoc. 188 (11): 1293–1295. PMID 3013820.
- ^ A b C Cartwright, S. F.; Lucas, M. & Huck, R. A (1971). "A small haemagglutinating porcine DNA virus. II. Biological and serological studies". J Comp Pathol. 81 (1): 145–155. doi:10.1016/0021-9975(71)90067-3. PMID 4933150.
- ^ McAdaragh, J. P. & Anderson, G. A. (1975). "Transmission of viruses through boar semen". In Proc 18th Annu Meet Am Assoc Vet Lab Diagn: 69–76.
- ^ A b Lucas, M. H.; Cartwright, S. F. & Wrathall, A. E. (1974). "Genital infection of pigs with porcine parvovirus". J Comp Pathol. 84 (3): 347–350. doi:10.1016/0021-9975(74)90008-5. PMID 4480374.
- ^ Mengeling, W. L, WL (1979). "Prenatal infection following maternal exposure to porcine parvovirus on either the seventh or fourteenth day of gestation". Can J Comp Med. 43 (1): 106–109. PMC 1319949. PMID 427636.
- ^ A b C d E F Mengeling, W. L.; Paul, P. S. & Brown, T. T. Jr (1980a). "Transplacental infection and embryonic death following maternal exposure to porcine parvovirus near the time of conception". Arch Virol. 65 (1): 55–62. doi:10.1007/BF01340540. PMID 7425850.
- ^ A b Donaldson-Wood, C. R.; Joo, H. S. & Johnson, R. H (1977). "The effect on reproductive performance of porcine parvovirus infection in a susceptible pig herd". Vet Rec. 100 (12): 237–239. doi:10.1136/vr.100.12.237. PMID 560744.
- ^ Gillick, J. C, JC (1977). "An outbreak of swine foetal mummification associated with porcine parvovirus". Aust Vet J. 53 (2): 105–106. doi:10.1111/j.1751-0813.1977.tb14903.x. PMID 856144.
- ^ A b Mengeling, W. L.; Cutlip, R. C. & Barnett, D. (1978). "Porcine parvovirus: Pathogenesis, prevalence, and prophylaxis". Proc Int Congr Pig Vet Soc. 5: KA 15.
- ^ Redman, D. R.; Bohl, E. H. & Ferguson, L. C (1974). "Porcine parvovirus: Natural and experimental infections of the porcine fetus and prevalence in mature swine". Infekce a imunita. 10 (4): 718–723. PMC 423012. PMID 4426705.
- ^ Bachmann, P. A., PA; Sheffy, B. E.; Vaughan, J. T (1975). "Experimental in utero infection of fetal pigs with a porcine parvovirus". Infekce a imunita. 12 (3): 455–460. PMC 415307. PMID 1165118.
- ^ A b C Cutlip, R. C. & Mengeling, W. L. (1975b). "Pathogenesis of in utero infection of eightand ten-week-old porcine fetuses with porcine parvovirus". Am J Vet Res. 36 (12): 1751–1754. PMID 1200446.
- ^ Choi, C. S.; Molitor, T. W.; Joo, H. S. & Gunther, R (1987). "Pathogenicity of a skin isolate of porcine parvovirus in swine fetuses". Vet Microbiol. 15 (1–2): 19–29. doi:10.1016/0378-1135(87)90125-8. PMID 2830705.
- ^ A b Wrathall, A. E. & Mengeling, W. L. (1979a). "Effect of porcine parvovirus on development of fertilized pig eggs in vitro". Br Vet J. 135 (3): 249–254. doi:10.1016/s0007-1935(17)32884-1. PMID 435962.
- ^ Wrathall, A. E. & Mengeling, W. L. (1979b). "Effect of transferring parvovirus-infected fertilized pig eggs into seronegative gilts". Br Vet J. 135 (3): 255–261. doi:10.1016/s0007-1935(17)32885-3. PMID 435963.
- ^ Wrathall, A. E. & Mengeling, W. L. (1979c). "Effect of inseminating seropositive gilts with semen containing porcine parvovirus". Br Vet J. 135 (5): 420–425. doi:10.1016/s0007-1935(17)32787-2. PMID 487052.
- ^ A b C d E Lenghaus, C.; Forman, A. J. & Hale, C. J. (1978). "Experimental infection of 35, 50 and 60 day old pig foetuses with porcine parvovirus". Aust Vet J. 54 (9): 418–422. doi:10.1111/j.1751-0813.1978.tb05565.x. PMID 743053.
- ^ Paul, P. S.; Mengeling, W. L. & Brown, T. T. Jr (1979). "Replication of porcine parvovirus in peripheral blood lymphocytes, monocytes, and peritoneal macrophages". Infekce a imunita. 25 (3): 1003–1007. PMC 414548. PMID 574124.
- ^ A b C d Hogg, G. G.; Lenghaus, C. & Forman, A. J. (1977). "Experimental porcine parvovirus infection of foetal pigs resulting in abortion, histological lesions and antibody formation". J Comp Pathol. 87 (4): 539–549. doi:10.1016/0021-9975(77)90060-3. PMID 591653.
- ^ A b C d Joo, H. S.; Donaldson-Wood, C. R.; Johnson, R. H. & Campbell, R. S. F. (1977). "Pathogenesis of porcine parvovirus infection: Pathology and immunofluorescence in the foetus". J Comp Pathol. 87 (3): 383–391. doi:10.1016/0021-9975(77)90028-7. PMID 332722.
- ^ Marrable, A. W. & Ashdown, R. R. (1967). "Quantitative observations on pig embryos of known ages". J Agric Sci. 69 (3): 443–447. doi:10.1017/S0021859600019134.
- ^ A b Rodeffer, H. E.; Leman, A. D.; Dunne, H. W.; Cropper, M. & Sprecher, D. J. (1975). "Reproductive failure in swine associated with maternal seroconversion for porcine parvovirus". J Am Vet Med Assoc. 166: 991–995.
- ^ A b Joo, H. S.; Donaldson-Wood, C. R. & Johnson, R. H (1976b). "Rapid diagnostic techniques for detection of porcine parvovirus infection in mummified foetuses". Aust Vet J. 52 (1): 51–2. doi:10.1111/j.1751-0813.1976.tb05380.x. PMID 944570.
- ^ Joo, H. S. & Johnson, R. H. (1977a). "Observations on rapid diagnosis of porcine parvovirus in mummified foetuses". Aust Vet J. 53 (2): 106–107. doi:10.1111/j.1751-0813.1977.tb14904.x. PMID 856145.
- ^ Cartwright, S. F. (1970). "Tests available for the detection of some virus infections of pigs and their interpretation". Vet Annu. 11: 77–82.
- ^ Chaniago, T. D.; Watson, D. L.; Owen, R. A. & Johnson, R. H. (1978). "Immunoglobulins in blood serum of foetal pigs". Australský veterinární věstník. 54 (1): 30–33. doi:10.1111/j.1751-0813.1978.tb00268.x. PMID 655968.
- ^ Cropper, M .; Dunne, H. W.; Leman, A. D.; Starkey, A. L. & Hoefling, D. C. (1976). "Prevalence of antibodies to porcine enteroviruses and porcine parvovirus in body fluids of fetal pigs from small vs. large litters". J Am Vet Med Assoc. 168 (3): 233–235. PMID 175042.
- ^ Ide, S .; Yamagishi, K.; Yoshimura, M.; Maniwa, E.; Yasuda, H. & Igarashi, J. (1977). "Reaction of pigs to injection with a bivalent vaccine of Japanese B encephalitis virus and porcine parvovirus". J Jpn Vet Med Assoc. 30 (6): 322–325. doi:10.12935/jvma1951.30.322.
- ^ A b Joo, H. S. & Johnson, R. H. (1977b). "Serological responses in pigs vaccinated with inactivated porcine parvovirus". Aust Vet J. 53 (11): 550–552. doi:10.1111/j.1751-0813.1977.tb07945.x. PMID 565631.
- ^ Mengeling, W. L. (1977). "Diagnosing porcine parvovirus-induced reproductive failure". In Proc 20th Annu Meet Am Assoc Vet Lab Diagn: 237–244.
- ^ A b Fujisaki, Y. (1978). "Incidence and control of stillbirth caused by porcine parvovirus in Japan". Proc Congr Int Pig Vet Soc. 5: KA 14.
- ^ Fujisaki, Y.; Watanabe, Y .; Kodama, K .; Hamada, H.; Murakami, Y .; Sugimori, T. & Sasahara, J. (1978b). "Protection of swine with inactivated porcine parvovirus vaccine from fetal infection". Natl Inst Anim Health Q (Tokyo). 18: 185.
- ^ A b C Mengeling, W. L.; Brown, T. T. Jr.; Paul, P. S. & Guntekunst, D. E (1979). "Efficacy of an inactivated virus vaccine for prevention of porcine parvovirus-induced reproductive failure". Am J Vet Res. 40 (2): 204–207. PMID 464358.
- ^ A b Mengeling, W. L.; Paul, P. S.; Gutekunst, D. E.; Pirtle, E. C. & Brown, T. T. Jr (1980b). "Vaccination for reproductive failure caused by porcine parvovirus". Proc Int Congr Pig Vet Soc. 6: 61.
- ^ A b C Paul, P. S. & Mengeling, W. L. (1980). "Evaluation of a modified live virus vaccine for the prevention of porcine parvovirus- induced reproductive disease in pigs". Am J Vet Res. 41 (12): 2007–2011. PMID 7212434.
- ^ Fujisaki, Y. & Murikami, Y (1982). "Immunity to infection with porcine parvovirus in pigs inoculated with attenuated HT-strain". Natl Inst Anim Health (Tokyo). 22: 36–37.
- ^ Fujisaki, Y.; Ichihara, T.; Sasaki, N .; Shimizu, F .; Murakami, Y .; Sugimori, T. & Sasahara, J. (1978a). "Field trials on inactivated porcine parvovirus vaccine for prevention of viral stillbirth among swine". Natl Inst Anim Health Q (Tokyo). 18: 184–185.
- ^ Paul, P. S. & Mengeling, W. L. (1986). "Vaccination of swine with inactivated porcine parvovirus vaccine in the presence of passive immunity". J Am Vet Med Assoc. 188 (4): 410–413. PMID 3949618.
- ^ Paul, P. S. & Mengeling, W. L. (1984). "Oronasal and intramuscular vaccination of swine with a modified live porcine parvovirus vaccine: Multiplication and transmission of vaccine virus". Am J Vet Res. 45 (12): 2481–2485. PMID 6098202.
- ^ Mengeling, W. L.; Pejsak, Z. & Paul, P. S (1984). "Biological assay of attenuated strain NADL-2 and virulent strain NADL-8 of porcine parvovirus". Am J Vet Res. 45 (11): 2403–2407. PMID 6098200.
![]() This article incorporates text from a "Diseases of Swine (8th edition)". According to its copyright statement, "Copyright is not claimed for Chapters 17, 23, 25, 31, and 64, which are in the veřejná doména.".
This article incorporates text from a "Diseases of Swine (8th edition)". According to its copyright statement, "Copyright is not claimed for Chapters 17, 23, 25, 31, and 64, which are in the veřejná doména.".
