Biokompatibilita s titanem - Titanium biocompatibility

Titan byl poprvé zaveden do ordinací v padesátých letech poté, co byl před deseti lety používán ve stomatologii. Nyní je kovem volby pro protetiku, vnitřní fixaci, zařízení vnitřního těla a přístrojové vybavení. Titan se používá od hlavy po paty v biomedicínských implantátech. Titan lze najít v neurochirurgii, sluchových pomůckách pro kostní vedení, implantátech falešných očí, spinální fúze klece, kardiostimulátory, prstové implantáty a náhrady ramen / loktů / kyčlí / kolen spolu s mnoha dalšími. Hlavním důvodem, proč se titan v těle často používá, je titan biokompatibilita a s povrchovými úpravami bioaktivní povrch. Vlastnosti povrchu, které ovlivňují biokompatibilitu, jsou povrchová struktura, sterická zábrana, vazebná místa a hydrofobicita (smáčení). Tyto vlastnosti jsou optimalizovány pro vytvoření ideální buněčné odezvy. Některé lékařské implantáty i části chirurgických nástrojů jsou potaženy nitrid titanu (Cín).
Biokompatibilita
Titan je považován za nejvíce biologicky kompatibilní kov díky své odolnosti proti korozi z tělesných tekutin, biologické inertnosti, schopnosti osseointegrace a vysokému limitu únavy. Schopnost titanu odolat drsnému tělesnému prostředí je výsledkem ochranného oxidového filmu, který se přirozeně vytváří v přítomnosti kyslíku. Oxidový film je silně přilnutý, nerozpustný a chemicky nepropustný, čímž brání reakcím mezi kovem a okolním prostředím.
Osseointegrační interakce a proliferace
Vysokoenergetické povrchy indukují angiogenezi během osseointegrace
Bylo navrženo, že kapacita titanu pro osseointegrace pochází z vysoké dielektrické konstanty jeho povrchového oxidu, který nedenaturuje proteiny (jako tantal, a kobalt slitiny ).[1] Jeho schopnost fyzicky se spojit s kostí dává titanu výhodu oproti jiným materiálům, které vyžadují použití lepidla, aby zůstaly připevněny. Titanové implantáty vydrží déle a k rozbití vazeb, které je spojují s tělem, jsou zapotřebí mnohem vyšší síly ve srovnání s jejich alternativami.[2]
Vlastnosti povrchu určují osseointegraci
Povrchové vlastnosti biomateriálu hrají důležitou roli při určování buněčné reakce (adheze a proliferace buněk) na materiál. Mikrostruktura titanu a vysoká povrchová energie mu umožňují vyvolat angiogenezi, která napomáhá procesu osseointegrace.[3]
Povrchová energie
Redoxní potenciál
Titan může mít mnoho různých standardních elektrodových potenciálů v závislosti na jeho oxidačním stavu. Pevný titan má a standardní elektrodový potenciál -1,63V. Materiály s vyšším standardním potenciálem elektrod jsou snáze redukovány, což z nich dělá lepší oxidační činidla.[4] Jak je vidět v tabulce níže, pevný titan upřednostňuje oxidaci, což z něj činí lepší redukční činidlo.
| Poloviční reakce | Standardní elektronový potenciál (V) |
|---|---|
| Ti2+ + 2 e− → Ti (s) | -1.63[4] |
| Ti3+ + 3 e− → Ti (s) | -1.21[5] |
| TiO2+ + 2 H+ + 4 e− → Ti (s) + H2Ó | -0.86[6] |
| 2 TiO2(s) + 2 H+ + 2 e− → Ti2Ó3(s) + H2Ó | -0.56[6] |
| Ti2+(aq) / M3+(aq) | -0.36[5] |
Povrchová úprava

Titan přirozeně pasivuje a vytváří oxidový film, který se stává heterogenním a polarizovaným jako funkce doby expozice tělesným prostředím.[7] To vede v průběhu času ke zvýšené adsorpci hydroxylových skupin, lipoproteinů a glykolipidů.[7] Adsorpce těchto sloučenin mění způsob interakce materiálu s tělem a může zlepšit biokompatibilitu. Ve slitinách titanu, jako jsou Ti-Zr a Ti-Nb, se ionty zirkonia a niobu, které se uvolňují v důsledku koroze, neuvolňují do těla pacienta, ale spíše se přidávají do pasivační vrstvy.[8] Legující prvky v pasivní vrstvě dodávají stupeň biokompatibility a odolnost proti korozi v závislosti na původním složení slitiny sypkého kovu před korozí.
Koncentrace proteinu na povrchu, (), je definován rovnicí
kde QREKLAMY je hustota povrchového náboje v C cm−2, M je molární hmotnost proteinu v g mol−1, n je počet přenesených elektronů (v tomto případě jeden elektron pro každou protonovanou aminoskupinu v proteinu) a F je Faradayova konstanta v C mol−1.
Rovnice pro frekvenci kolizí je následující:
kde D = 8,83 × 10−7 cm2 s−1 je difúzní koeficient molekuly BSA při 310 K, d = 7,2 nm je „průměr“ proteinu, který odpovídá dvojnásobku Stokesova poloměru, NA = 6,023 × 1023 mol−1 je Avogadro číslo a c * = 0,23 g L−1 (3,3 μM) je kritická objemová koncentrace přesycení.
Smáčení a pevný povrch
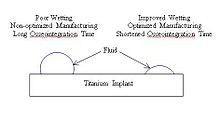
Smáčení nastává jako funkce dvou parametrů: drsnosti povrchu a povrchového zlomku.[10] Zvýšením smáčení mohou implantáty snížit čas potřebný pro osseointegraci tím, že umožní buňkám snadněji se vázat na povrch implantátu.[2] Smáčení titanu lze upravit optimalizací parametrů procesu, jako je teplota, čas a tlak (viz tabulka níže). Titan se stabilními vrstvami oxidu převážně sestávající z TiO2 má za následek lepší smáčení implantátu při kontaktu s fyziologickou tekutinou.[11]
| Povrch | Smáčivý úhel (stupně) | Tlak (mbar) během zpracování | Teplota (stupně C) během zpracování | Ostatní povrchové zpracování |
|---|---|---|---|---|
| Holé Ti | ~50[9] | - | - | Žádný |
| TiO2 TiO Ti4Ó7 TiO4 (Rovinné) | ~33[11] | 2.2 | 700 | Oxidace |
| TiO2 TiO Ti4Ó7 (Rovinné) | ~45[11] | 4 | 700 | Oxidace |
| TiO2 TiO Ti4Ó7 TiO4 (Dutý) | ~32[11] | 2.2 | 400 | Oxidace |
| TiO2 TiO Ti4Ó7 (Dutý) | ~25[11] | 2.6 | 500 | Oxidace |
| TiO2 TiO Ti4Ó7 (Dutý) | ~8[11] | 4 | 400 | Oxidace |
| TiO2 TiO Ti4Ó7 (Dutý) | ~20[11] | 4 | 500 | Oxidace |
| Ti se zdrsněným povrchem | 79.5 ± 4.6[12] | - | - | Obráběný povrch |
| Ti s alkalicky upraveným povrchem | 27.2 ± 6.9[12] | - | - | Bio-povrch |
Adsorpce
Koroze
Mechanické obroušení filmu oxidu titaničitého vede ke zvýšené rychlosti koroze.[13]
Titan a jeho slitiny nejsou v lidském těle imunní vůči korozi. Slitiny titanu jsou náchylné k absorpci vodíku, což může vyvolat srážení hydridů a způsobit křehnutí, které vede k selhání materiálu.[13] „Vodíkové křehnutí bylo pozorováno jako mechanismus degradace in vivo za podmínek koroze třením a štěrbin, což má za následek tvorbu TiH, povrchovou reakci a praskání uvnitř zužujících se modulárních těles Ti / Ti.“[13] Studium a testování chování titanu v těle nám umožňuje vyhnout se nesprávným praktikám, které by mohly vést k fatálnímu poškození implantátu, jako je používání dentálních produktů s vysokou koncentrací fluoridů nebo látek schopných snižovat pH média v okolí implantátu.[14]
Přilnavost
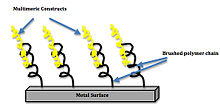
Buňky na rozhraní implantátu jsou vysoce citlivé na cizí předměty. Když jsou implantáty instalovány do těla, buňky iniciují zánětlivou reakci, která by mohla vést k zapouzdření a narušit fungování implantovaného zařízení.[15]
Ideální buněčná odpověď na bioaktivní povrch je charakterizována stabilizací a integrací biomateriálu a také snížením potenciálních míst bakteriální infekce na povrchu. Jedním příkladem integrace biomateriálu je titanový implantát s technickým provedením biorozhraní pokryté biomimetický motivy. Ukázalo se, že povrchy s těmito biomimetickými motivy zvyšují vazbu a signalizaci integrinu a diferenciaci kmenových buněk. Zvýšení hustoty shlukování ligandů také zvýšilo vazbu integrinu. Povlak skládající se z trimerů a pentamerů zvýšil kontaktní plochu kostního implantátu o 75% ve srovnání se současným klinickým standardem nepotaženého titanu.[16] Toto zvětšení plochy umožňuje zvýšenou integraci buněk a snižuje odmítnutí implantovaného zařízení. The Langmuirova izoterma:
,[9]
kde c je koncentrace adsorbátu je maximální množství adsorbovaného proteinu, BREKLAMY je afinita molekul adsorbátu k adsorpčním místům. Langmuirova izoterma může být linearizována přeskupením rovnice na,
Tato simulace je dobrou aproximací adsorpce na povrch ve srovnání s experimentálními hodnotami.[9] Langmuirovu izotermu pro adsorpci prvků na povrch titanu lze určit vynesením známých parametrů. Experiment z fibrinogen adsorpce na povrchu titanu „potvrdila použitelnost Langmuirovy izotermy v popisu adsorpce fibrinogenu na povrch Ti.“[9]
Viz také
Reference
- ^ Black J (1994) Biologická účinnost tantalu. Clin Mater 16: 167–173.
- ^ A b Raines, Andrew L .; Olivares-Navarrete, René; Wieland, Marco; Cochran, David L .; Schwartz, Zvi; Boyan, Barbara D. (2010). „Regulace angiogeneze během osseointegrace povrchovou mikrostrukturou a energií titanu“. Biomateriály. 31 (18): 4909–17. doi:10.1016 / j.biomaterials.2010.02.071. PMC 2896824. PMID 20356623.
- ^ http://titaniumthemetal.org/Resources/DataSheetMedical.pdf
- ^ A b „Standardní redukční potenciály (25 ° C)“.
- ^ A b Brown, Doc. "Chemistry of Titanium".
- ^ A b Zima, Marku. „Sloučeniny titanu“.
- ^ A b Healy, Kevin E .; Ducheyne, Paul (1991). „Fyzický model rozhraní titan-tkáň“. Transakce ASAIO. 37 (3): M150–1. PMID 1751087.
- ^ Long, Marc; Rack, HJ (1998). „Slitiny titanu v celkové náhradě kloubů - perspektiva vědy o materiálech“. Biomateriály. 19 (18): 1621–39. doi:10.1016 / S0142-9612 (97) 00146-4. PMID 9839998.
- ^ A b C d E F G Jackson, Douglas R .; Omanović, Saša; Roscoe, Sharon G. (2000). „Elektrochemické studie adsorpčního chování sérových proteinů na titanu“. Langmuir. 16 (12): 5449–57. doi:10.1021 / la991497x.
- ^ Bico, José; Thiele, Uwe; Quéré, David (2002). Msgstr "Smáčení strukturovaných povrchů". Koloidy a povrchy A: Fyzikálně-chemické a technické aspekty. 206 (1–3): 41–6. doi:10.1016 / S0927-7757 (02) 00061-4.
- ^ A b C d E F G Silva, M.A.M .; Martinelli, A.E .; Alves, C .; Nascimento, R.M .; Távora, M.P .; Vilar, C.D. (2006). "Povrchová modifikace Ti implantátů oxidací plazmy ve výboji s dutou katodou". Technologie povrchů a povlaků. 200 (8): 2618–26. doi:10.1016 / j.surfcoat.2004.12.027.
- ^ A b Strnad, Jakub; Strnad, Zdeněk; Šesták, Jaroslav; Urban, Karel; Povýšil, Ctibor (2007). „Bioaktivovaný titanový povrch využitelný pro imitaci implantace kosti ve stomatologii - Část III: Vlastnosti povrchu a tvorba kontaktu kost-implantát“. Journal of Physics and Chemistry of Solids. 68 (5–6): 841–5. Bibcode:2007JPCS ... 68..841S. doi:10.1016 / j.jpcs.2007.02.040.
- ^ A b C Rodrigues, Danieli C .; Urban, Robert M .; Jacobs, Joshua J .; Gilbert, Jeremy L. (2009). "In vivo silná koroze a vodíkové křehnutí získaných modulárních tělesných titanových slitinových kyčelních implantátů ". Journal of Biomedical Materials Research Part B: Applied Biomaterials. 88 (1): 206–19. doi:10,1002 / jbm.b.31171. PMC 2667129. PMID 18683224.
- ^ http://www.dynadental.com/editor/download-121/091102%20Nakagawa%20M%20-%20Effect%20of%20Fluoride%20and%20pH%20on%20Titanium%20-%20ENG.pdf
- ^ Franz, Sandra; Rammelt, Stefan; Scharnweber, Dieter; Simon, Jan C. (2011). „Imunitní reakce na implantáty - přehled důsledků pro návrh imunomodulačních biomateriálů“. Biomateriály. 32 (28): 6692–709. doi:10.1016 / j.biomaterials.2011.05.078. PMID 21715002.
- ^ Petrie, T. A .; Raynor, J. E.; Dumbauld, D. W .; Lee, T. T .; Jagtap, S .; Templeman, K. L .; Collard, D. M .; Garcia, A. J. (2010). „Multivalentní integriny specifické ligandy zvyšují hojení tkání a integraci biomateriálů“. Science Translational Medicine. 2 (45): 45ra60. doi:10.1126 / scitranslmed.3001002. PMC 3128787. PMID 20720217.





