Místo vstupu ribosomu do viru hepatitidy A (IRES) - Hepatitis A virus internal ribosome entry site (IRES)
| Místo vstupu ribosomu do viru hepatitidy A (IRES) | |
|---|---|
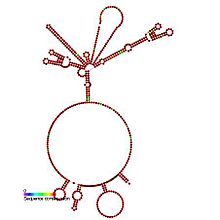 Předpovězeno sekundární struktura a zachování sekvence z IRES_HepA | |
| Identifikátory | |
| Symbol | IRES_HepA |
| Alt. Symboly | HepA_IRES |
| Rfam | RF00228 |
| Další údaje | |
| RNA typ | Cis-reg; IRES |
| Domény | Viry |
| JÍT | GO termín musí začínat GO: |
| TAK | SO: 0000243 |
| PDB struktur | PDBe |
Tato rodina představuje interní místo vstupu ribozomu (IRES) z virus hepatitidy A..[1] HAV IRES je sekvence dlouhá 450 nukleotidů[2] nachází se v 735 nt dlouhém 5 'UTR (nepřekládaném regionu) viru hepatitidy A. Genom RNA.[1] Prvky IRES umožňují čepici a koncovku nezávislou překlad z mRNA v hostitelské buňce. IRES toho dosahuje zprostředkováním vnitřní iniciace překlad náborem a ribozomální Předinicializační komplex 40S přímo do iniciační kodon a eliminuje požadavek na eukaryotický iniciační faktor, eIF4F.[3]
Historie a pozadí
IRES byl poprvé objeven v genomu RNA z Picornaviridae Norman Sonenberg v roce 1988.[4] Zpočátku identifikovaný 5 'UTR z poliovirus (PV), který řídil vnitřní iniciaci pro syntézu proteinů, byl nazýván ribozomová přistávací plošina (RLP). Tento termín byl brzy poté nahrazen interním místem vstupu ribozomu, které se dnes také běžněji používá.[5] V roce 1988 pouze virus encefalomycoarditidy (EMCV ) a PV byly použity k prokázání schopnosti IRES.[6] Výzkum identifikující IRES v HAV provedli v roce 1993 Michael J. Glass, Xi-Yu Jia a Donald F. Summers. Jejich výzkum ukázal, že IRES HAV se nacházel pod nukleotidem 45 a zahrnoval až nukleotid 734.[7] Interní zahájení proteinové syntézy nezávislé na víčku se liší od normální iniciace translace závislé na buněčném víčku. eIF4 (eukaryotický iniciační faktor 4) jako celý komplex složený z eIF4A, eIF4B, eIF4E a eIF4G. eIF4F se používá k označení komplexu, který zahrnuje eIF4E, 4G a 4A.[5] Při iniciaci translace závislé na čepici se eIF4F váže na čepici m7G na 5 'konci UTR a získává 40S malá ribozomální podjednotka a skenování po směru pro počáteční kodon AUG.[1] Ukázalo se, že interní iniciace nezávislá na čepici interferuje buď s částmi eIF4, nebo s celým komplexem.[5]
Funkce
Bez obalu v cytoplazmě iniciuje genom HAV translaci nezávisle na 5´ čepici, aby syntetizoval své virové proteiny. The sekundární struktura HAV IRES je jak nezbytné, tak postačující pro to, aby genom získal ribozom a zahájil translaci. Ribosom hostitelské buňky rozpozná IRES a bude přímo vstupovat v sekvenci, místo aby skenoval z 5 'konce.[2] Genom HAV nekóduje proteiny, které mají schopnost vypnout hostitelský protein. Proto musí HAV IRES soutěžit s mRNA zakončenou hostitelskou buňkou m7G.[8] Bohužel iniciace translace HAV IRES není tak účinná jako typická čepička m7G hostitelské buňky. Ačkoli struktura HAV IRES má afinitu k eIF4F, její afinita není zdaleka tak vysoká jako mRNA limitované hostitelskou buňkou. To má za následek delší dobu potřebnou k dosažení maximálního vylučování viru. To také vede k buněčné smrti, ke které dochází pouze z imunitních odpovědí hostitele spíše než z lýzy.[1]
Potlačení IRES
Protože eIF4F hraje zásadní roli při iniciaci HAV IRES, je cílem potlačení IRES. Štěpení eIF4G, proteinový skelet eIF4F, sekvenčně specifickými proteázami 2A proteázou nebo L-proteázou, povede k vysoce inhibované aktivitě HAV IRES. Tyto proteázy jsou kódovány dalšími členy Picornaviridae rodina. Například virus slintavky a kulhavky (FMDV) kóduje tyto proteázy, aby inhibovaly translaci buněčné mRNA a zároveň umožnily translaci virové RNA.[2] Požadavek intaktního eIF4G na zahájení IRES je specifický pro HAV IRES mezi jinými pikornaviry.[6] eIF4E-vazebný protein I (4E-BP1) bude také interferovat s eIF4G proteinem. 4E-BP1 funguje tak, že sekvestruje eIF4E, čímž inhibuje jeho asociaci s eIF4G a vede k inaktivaci HAV IRES (1). Další metodou k deaktivaci aktivity eIF4F jsou účinky analogu víčka m7GpppG, který cílí na eIF4E a poté je schopen zabránit jeho asociaci s uzavřenými 5 'konci mRNA. Přesný mechanismus, kterým tento analog s čepicí interferuje s IRES, není jasný, ale předpokládá se, že vazba tohoto analogu na eIF4E má za následek konformační změnu eIF4G, což narušuje normální funkci eIF4G.[2]
glyceraldehyd-3-fosfát-dehydrogenáza (GAPDH)
Glyceraldehyd-3-fosfát-dehydrogenáza (GAPDH ) je buněčný enzym, který se obvykle podílí na glykolýza. Je známo, že GAPDH se váže na překrývající se místa v kmenové smyčce IIIa v HAV IRES. Kmenová smyčka IIIa obsahuje UU delece nukleotidů uvnitř 5 nukleotidové sekvence, která zvyšuje aktivitu IRES. GAPDH účinně vázající se na tuto oblast destabilizuje sekundární strukturu, kterou tvoří IRES, a potlačuje schopnost IRES provádět překlad nezávislý na čepici.[9]
Potlačení La proteinu
Protein hostitelské buňky, který se široce a výlučně vyskytuje v eukaryotických buňkách, se La protein váže přímo na specifické oblasti na HAV IRES během translace mRNA a také Replikace RNA. Ve studii z roku 2008 bylo pozorováno, že cytoplazmatická La snižuje iniciaci HAV IRES.[8] V roce 2014 však novější studie prokázala úspěšnou inhibici (in vivo) proteinu La jako navrhovanou metodu inhibice translace a replikace HAV IRES, což znamená, že více než pravděpodobně hraje nedílnou roli v translaci a replikaci HAV.[10]
Amantadin
Amantadin, tricyklická symetrická amin, je osvědčený supresor, který specificky inhibuje HAV IRES závislou translaci HAV RNA. Experiment z roku 2005 ukázal, že amantadin potlačil translaci HAV IRES a nespustil reakci interferonu, což naznačuje slibné antivirové použití amantadinu.[4] Pro virus chřipky A., jeho primární metodou působení jako antivirotika je zabránit odvíjení virového genomu, který inhibuje HAV IRES zprostředkovanou translaci a replikaci. Účinnost amantadinu vychází z umístění IRES v regionu 5’NTR, který má vysokou afinitu k antivirotikům, což z něj činí efektivní cíl. Také se ukázalo, že M2 protein viru chřipky A by mohl být dalším životaschopným cílem potenciálního antivirotika.[11]
Bylo zjištěno, že všechny pikornaviry obsahují IRES.[12] V rámci IRES jsou čtyři třídy Picornaviridae rodina, v rozmezí 270–450 nt.[5] Mezi pikornaviry obsahuje mnoho 5 ’UTR také další strukturní prvky proti proudu, které mohou napomáhat virovému genomu při replikaci. Mnoho pikornavirů IRES také umožňuje mnoha virům blokovat iniciaci závislou na čepici, což má za následek vypnutí syntézy proteinů hostitelských buněk.[5]Čtyři třídy jsou Entero- / rhinovirus IRES, Kardio- / aftovirus IRES, HAV IRES, HCV podobný pikornavirus IRES. Tyto IRES jsou kategorizovány podle jejich nukleotidových sekvencí, ale sdílejí strukturní podobnost, protože je to struktura RNA, která má schopnost interně získávat translační mechanizmy.[6] Prvky IRES entero- / rhinoviru sdílejí některé strukturální motivy s HAV IRES. HAV IRES, entero- / rhinovirus a kardio- / apthovirus IRES jsou všechny přibližně 450 nt, ale velmi se liší svou strukturou. Kardiovirus, EMCV a apthovirus, virus slintavky a kulhavky (FMDV) sdílejí přibližně 50% identických prvků IRES. Pikornavirus podobný HCV IRES obsahuje největší rozdíl v prvcích IRES z ostatních tří tříd. Existuje široká škála Picornaviridae viry, které mají vysoce konzervované HCV podobné prvky IRES, u některých se předpokládá, že budou stále identifikovány.[5] Je důležité si uvědomit, že aktivita HAV IRES se liší od ostatních tří tříd v konkrétním požadavku na neporušený eIF4G. Jiné pikornaviry kódují proteiny, které budou štěpit eIF4G pro zvýšenou aktivitu IRES.[2]
Reference
- ^ A b C d Brown EA, Zajac AJ, Lemon SM (únor 1994). „In vitro charakterizace vnitřního ribozomálního vstupního místa (IRES) přítomného v 5 'nepřekládané oblasti RNA viru hepatitidy A: srovnání s IRES viru encefalomyokarditidy“. Journal of Virology. 68 (2): 1066–1074. PMC 236545. PMID 8289336.
- ^ A b C d E Ali IK, McKendrick L, Morley SJ, Jackson RJ (září 2001). „Aktivita viru hepatitidy A IRES vyžaduje asociaci mezi iniciačním faktorem vazby na čepici (eIF4E) a eIF4G.“. Journal of Virology. 75 (17): 7854–7863. doi:10.1128 / jvi.75.17.7854-7863.2001. PMC 115028. PMID 11483729.
- ^ Kolupaeva VG, Pestova TV, Hellen CU (prosinec 2000). „Ribozomální vazba na vnitřní místo vstupu ribozomu viru klasického moru prasat“. RNA. 6 (12): 1791–1807. doi:10.1017 / S1355838200000662. PMC 1370049. PMID 11142379.
- ^ A b Kanda T, Yokosuka O, Imazeki F, Fujiwara K, Nagao K, Saisho H (červen 2005). „Amantadin inhibuje interní translaci zprostředkovanou místem vstupu viru hepatitidy A do buněk lidského hepatomu“. Sdělení o biochemickém a biofyzikálním výzkumu. 331 (2): 621–629. doi:10.1016 / j.bbrc.2005.03.212. PMID 15850805.
- ^ A b C d E F Belsham GJ (únor 2009). "Odlišné prvky IRES pikoraviru". Virový výzkum. 139 (2): 183–192. doi:10.1016 / j.virusres.2008.07.001. PMID 18675861.
- ^ A b C Fernández-Miragall O, López de Quinto S, Martínez-Salas E (únor 2009). "Relevance struktury RNA pro aktivitu prvků IRES picornaviru". Virový výzkum. 139 (2): 172–182. doi:10.1016 / j.virusres.2008.07.009. PMID 18692097.
- ^ Glass MJ, Jia XY, Summers DF (duben 1993). „Identifikace vnitřního místa vstupu ribozomu viru hepatitidy A: in vivo a in vitro analýza bicistronových RNA obsahujících nekódující oblast HAV 5 '“. Virologie. 193 (2): 842–852. doi:10.1006 / viro.1993.1193. PMID 8384758.
- ^ A b Cordes S, Kusov Y, Heise T, Gauss-Müller V (duben 2008). „La autoantigen potlačuje IRES-dependentní překlad viru hepatitidy A“. Sdělení o biochemickém a biofyzikálním výzkumu. 368 (4): 1014–1019. doi:10.1016 / j.bbrc.2008.01.163. PMID 18282467.
- ^ Yi M, Schultz DE, Lemon SM (červenec 2000). „Funkční význam interakce RNA viru hepatitidy A s glyceraldehyd-3-fosfátdehydrogenázou (GAPDH): opačné účinky GAPDH a proteinu vázajícího polypyrimidinový trakt na funkci vnitřního místa vstupu ribozomu“. Journal of Virology. 74 (14): 6459–6468. doi:10.1128 / jvi.74.14.6459-6468.2000. PMC 112154. PMID 10864658.
- ^ Jiang X, Kanda T, Wu S, Nakamoto S, Saito K, Shirasawa H, Kiyohara T, Ishii K, Wakita T, Okamoto H, Yokosuka O (2014). „Potlačení antigenu La vyvolává potenciální antivirové účinky proti viru hepatitidy A“. PLOS ONE. 9 (7): e101993. doi:10.1371 / journal.pone.0101993. PMC 4084951. PMID 24999657.
- ^ Yang L, Kiyohara T, Kanda T, Imazeki F, Fujiwara K, Gauss-Müller V, Ishii K, Wakita T, Yokosuka O (září 2010). „Inhibiční účinky na HAV IRES zprostředkovanou translaci a replikaci kombinací amantadinu a interferonu-alfa“. Virology Journal. 7 (1): 212. doi:10.1186 / 1743-422x-7-212. PMC 2940810. PMID 20815893.
- ^ Hellen CU, Sarnow P (červenec 2001). „Vnitřní místa vstupu ribozomu v eukaryotických molekulách mRNA“. Geny a vývoj. 15 (13): 1593–1612. doi:10,1101 / gad.891101. PMID 11445534.
