Rychlá paralelní proteolýza - Fast parallel proteolysis - Wikipedia
Rychlá paralelní proteolýza (FASTpp) je metoda pro stanovení termostabilita z bílkoviny měřením, která frakce proteinu odolává rychlému proteolytickému trávení.[1]
Historie a pozadí
Proteolýza je široce používán v biochemie a buněčná biologie zkoumat proteinová struktura.[2][3] Při "omezené proteolýze trypsinu" je nízké množství proteáza strávit obojí složený a rozvinutý protein, ale do značné míry různými rychlostmi: nestrukturované proteiny jsou štěpeny rychleji, zatímco strukturované proteiny jsou štěpeny pomaleji (někdy řádově). Nedávno bylo navrženo několik dalších testů stability proteinu založených na proteolýze, využívajících jiné proteázy s vysokou specificitou pro štěpení rozložených proteinů. Patří mezi ně pulzní proteolýza,[4] Proteolytická skenovací kalorimetrie [5] a FASTpp.
Jak to funguje
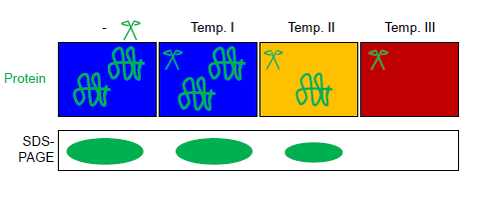
FASTpp měří množství bílkovin, které odolává trávení za různých podmínek. Za tímto účelem se používá termostabilní proteáza, která se specificky štěpí na exponovaném místě hydrofobní zbytky. Stanovení FASTpp kombinuje tepelný rozklad, specificitu termostabilní proteázy pro rozvinutou frakci a separační sílu SDS-PAGE.[6] Díky této kombinaci dokáže FASTpp detekovat změny ve složce složené ve velkém fyzikálně-chemickém rozsahu podmínek, včetně teplot až 85 ° C, pH 6-9, přítomnost nebo nepřítomnost celku proteom. Rozsah aplikací od biotechnologie studovat bodové mutace a testy vazby ligandů.
Aplikace
FASTpp byl použit k testování:[1]
- Vliv lyzátu na stabilitu bílkovin
- Stabilita tepelného proteomu [7]
- Spojené skládání a vázání [8]
- Účinky ligandu na složení zlomku a stabilitu [9]
- Účinky mutací na složenou frakci a stabilitu (např. bodová mutace /missense mutace[9][10])
- Stabilita kinetického proteinu [11]
Technologie
Nejprve je buněčný lyzát generován rozbitím skleněných kuliček, tlakovou homogenizací nebo chemickými nebo fyzikálními metodami lýzy, které nedenaturují požadovaný protein (proteiny). (Volitelně pro cílenou analýzu) je z tohoto lyzátu purifikován požadovaný protein afinitními metodami založenými na značkách s vnitřní poruchou [12] nebo jiné vhodné strategie čištění, často zahrnující několik ortogonálních chromatografických kroků.
Tento (celkový nebo vyčištěný) proteinový roztok se rozdělí na alikvoty do několika zkumavek PCR proužku. Všechny alikvoty jsou vystaveny paralelně v cyklovači PCR s tepelným gradientem různým maximálním teplotám v přítomnosti termostabilní proteázy thermolysinu (viz obrázek). Automatizované regulace teploty se dosahuje v cyklovači s tepelným gradientem (běžně používaný pro PCR ). Reakční produkty lze oddělit pomocí SDS-PAGE nebo western blot.[6] Proteázový termolyzin může být plně inaktivován EDTA. Tato vlastnost termolyzin dělá FASTpp kompatibilní s následujícími trypsin trávení např. pro hmotnostní spektrometrie.[13][14][7]
Reference
- ^ A b Minde, D. P .; Maurice, M. M .; Rüdiger, S. G. D. (2012). Uversky, Vladimir N (ed.). „Stanovení biofyzikální stability proteinu v lyzátech rychlou analýzou proteolýzy, FASTpp“. PLOS ONE. 7 (10): e46147. doi:10.1371 / journal.pone.0046147. PMC 3463568. PMID 23056252.
- ^ Johnson, D. E.; Xue, B .; Sickmeier, M. D .; Meng, J .; Cortese, M. S .; Oldfield, C. J .; Le Gall, T .; Dunker, A. K .; Uversky, V. N. (2012). „Vysoce výkonná charakterizace vnitřní poruchy proteinů z iniciativy Protein Structure Initiative“. Journal of Structural Biology. 180 (1): 201–215. doi:10.1016 / j.jsb.2012.05.013. PMC 3578346. PMID 22651963.
- ^ Hoelen, H .; Kleizen, B .; Schmidt, A .; Richardson, J .; Charitou, P .; Thomas, P. J .; Braakman, I. (2010). Uversky, Vladimir N (ed.). „Během překládání mutantní domény se objevila primární chyba skládání a záchrana ΔF508 CFTR“. PLOS ONE. 5 (11): e15458. doi:10.1371 / journal.pone.0015458. PMC 2994901. PMID 21152102.
- ^ Park, C .; Marqusee, S. (2005). "Pulzní proteolýza: Jednoduchá metoda pro kvantitativní stanovení stability proteinu a vazby ligandu". Přírodní metody. 2 (3): 207–212. doi:10.1038 / nmeth740. PMID 15782190.
- ^ Tur-Arlandis, G .; Rodriguez-Larrea, D .; Ibarra-Molero, B .; Sanchez-Ruiz, J. M. (2010). „Proteolytická skenovací kalorimetrie: nová metodika, která zkoumá základní vlastnosti kinetické stability proteinů“. Biofyzikální deník. 98 (6): L12 – L14. doi:10.1016 / j.bpj.2009.11.028. PMC 2849053. PMID 20303845.
- ^ A b Laemmli, Velká Británie (1970). "Štěpení strukturních proteinů během montáže hlavy bakteriofága T4". Příroda. 227 (5259): 680–685. doi:10.1038 / 227680a0. PMID 5432063.
- ^ A b Leuenberger, P; Ganscha, S; Kahraman, A (2017). „Celobuněčná analýza tepelného rozložení proteinu odhaluje determinanty termostability“. Věda. 355 (6327): eaai7825. doi:10.1126 / science.aai7825. PMID 28232526.
- ^ Demarest, S. J .; Martinez-Yamout, M .; Chung, J .; Chen, H .; Xu, W .; Dyson, H. J.; Evans, R. M .; Wright, P. E. (2002). "Vzájemné synergické skládání při náboru CBP / p300 koaktivátory jaderných receptorů p160". Příroda. 415 (6871): 549–553. doi:10.1038 / 415549a. PMID 11823864.
- ^ A b Robaszkiewicz, K .; Ostrowska, Z .; Cyranka-Czaja, A .; Moraczewska, J. (2015). „Narušené interakce tropomyosin – troponin snižují aktivaci tenkého vlákna aktinu“. Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1854 (5): 381–390. doi:10.1016 / j.bbapap.2015.01.004. PMID 25603119.
- ^ Minde, D. P .; Anvarian, Z .; Rüdiger, S. G .; Maurice, M. M. (2011). „Porucha nepořádku: Jak vedou mutace missense v APC potlačujícími nádory k rakovině?“. Molekulární rakovina. 10: 101. doi:10.1186/1476-4598-10-101. PMC 3170638. PMID 21859464.
- ^ Tur-Arlandis, G .; Rodriguez-Larrea, D .; Ibarra-Molero, B .; Sanchez-Ruiz, J. M. (2010). „Proteolytická skenovací kalorimetrie: nová metodika, která zkoumá základní vlastnosti kinetické stability proteinů“. Biofyzikální deník. 98 (6): L12 – L14. doi:10.1016 / j.bpj.2009.11.028. PMC 2849053. PMID 20303845.
- ^ Minde, DP; Halff, EF; Tans, SJ (2013). „Designing disorder: Tales of the neočekávaných ocasů“. Jiskrově neuspořádané proteiny. 1 (1): e26790. doi:10,4161 / idp.26790. PMC 5424805. PMID 28516025.
- ^ Chang, Y; Schlebach, JP; Verheul, RA; Park, C (2012). „Zjednodušený proteomický přístup k objevování interakcí protein-ligand“. Věda o bílkovinách. 21 (9): 1280–7. doi:10.1002 / pro.2122. PMC 3631357. PMID 22733688.
- ^ Park, C; Marqusee, S (2005). "Pulzní proteolýza: Jednoduchá metoda pro kvantitativní stanovení stability proteinu a vazby ligandu". Přírodní metody. 2 (3): 207–12. doi:10.1038 / nmeth740. PMID 15782190.
