Dehalogenace - Dehalogenation
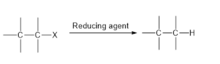
Dehalogenace je chemická reakce, která zahrnuje štěpení C-halogenové vazby za vzniku produktu. Dehalogenaci lze rozdělit do dvou podtříd: reduktivní dehalogenace a hydrodehalogenace.
Dějiny
Organické halogenidy patří do třídy organických sloučenin, které obsahují vazbu uhlík-halogen. V roce 1832 pojmenovaný vědec Justus von Liebig syntetizoval první organický halogenid (uhlí) chlorací ethanolu. Od té doby si organické halogenidy získaly velkou pozornost.[1] Organohalogenidy se běžně používají jako pesticidy, biologicky rozložitelné látky, fumiganty v půdě, chladiva, chemická činidla - rozpouštědla a polymery.[2][3][4] Byl klasifikován jako znečišťující látka i přes jeho široké použití v různých aplikacích. Z tohoto důvodu je dehalogenace klíčovou reakcí na přeměnu toxických organohalogenidů na méně nebezpečné produkty.
Rychlost dehalogenace
Mezi halogeny, fluor je nejvíce elektronegativní atom a bude mít nejvyšší tendenci vytvářet nejsilnější vazbu s uhlíkem. Rychlost dehalogenace závisí na síle vazby mezi atomem uhlíku a atomem halogenu. Energie disociace vazby uhlík-halogenových vazeb jsou popsány jako: H3C-I (234 kJmol-1), H3C-Br (293 kJmol-1), H3C-Cl (351 kJmol-1) a H3C-F (452 kJmol) -1). Pro stejné struktury bude tedy rychlost disociace vazby pro dehalogenaci: F << Cl
[4] Rychlost dehalogenace pro alkylhalogenid se navíc mění podle sterického prostředí a sleduje tento trend: primární> sekundární> terciární halogenidy.[4]
Dehalogenace za použití různých katalyzátorů
Rychlost dehalogenace se liší podle typu substrátu, oxidačního stavu kovu a redukčních činidel použitých během reakce.
Dehalogenace za použití alkalických kovů a kovů alkalických zemin
Alkalické kovy a kovy alkalických zemin, jako je lithium, sodík, draslík, hořčík a vápník, se ukázaly jako skvělé dehalogenační katalyzátory. Během dehalogenační reakce působí kovy jako redukční činidlo pro štěpení vazeb uhlík-halogen. Halogen pak může odejít jako odcházející skupina. Obecný způsob syntézy alkanů pomocí alkalických kovů a kovů alkalických zemin je uveden ve schématu 2:
Yus a jeho spolupracovníci syntetizovali různé lithiumnaftalenidové sloučeniny, které působí jako katalyzátor pro lithiaci různých funkcionalizovaných halogenovaných arenů. Li-aren reagoval s vodou nebo deuteriem za vzniku dehalogenovaného produktu.[5][6][7] Hlavní nevýhodou použití lithiových naftalenových katalyzátorů je to, že je těžké oddělit se od reakční směsi, protože naftalen se adsorbuje na povrchu arenových substrátů. V polymerní chemii se pro proces dehalogenace používá kov sodný.[8][9]Odstranění atomu halogenu z halogenidů arenu v přítomnosti Grignardova činidla a vody za vzniku nové sloučeniny je známé jako Grignardova degradace. Dehalogenace pomocí Grignardových činidel je dvoukrokový proces hydrodehalogenace. Reakce začíná tvorbou sloučeniny alkyl / aren-hořčík-halogen, po které následuje přidání zdroje protonu za vzniku dehalogenovaného produktu. Egorov a jeho spolupracovníci ohlásili dehalogenaci benzylhalogenidů za použití atomového hořčíku ve stavu 3P při 600 ° C. Jako produkt reakce byl vyroben toluen a b-benzyl.[10] Morisson a jeho spolupracovníci také uváděli dehalogenaci organických halogenidů bleskovou vakuovou pyrolýzou za použití hořčíku.[11]
Dehalogenace pomocí komplexů přechodových kovů v 1. řadě
Mnoho skupin uvádí dehalogenační procesy používající různé formy homogenních a heterogenních komplexů přechodných kovů, jako je 0M, komplexy kov-ligand, kovové soli a kov nesené na různých nosičích.[12] Sloučeniny vanadu ve svém nízkém oxidačním stavu mají tendenci provádět dehalogenační reakci pomocí jedné elektronové redukce. Účinnost systému přenosu jednoho elektronu závisí na redoxním potenciálu jak komplexů vanadu, tak radikofilů.[13] Dihydrid lithný chromitý[14] se také používá jako univerzální redukční činidlo k dehalogenaci různých alkyl nebo arylhalogenidů, jak je znázorněno ve schématu 3:

Kromě těchto kovů je železo nejvíce studovaným kovem pro dehalogenační reakci. Cahiez a jeho spolupracovníci uváděli redukci bromalkenů za použití halogenidu manganatého v přítomnosti Fe (acac) 3.[15] Mohamed a spolupracovníci, inspirovaní touto prací, také provedli hydrobromaci 1,1 -dibromo-1-alkenů v přítomnosti Grignardových činidel a přechodných kovů, jako je Fe a kobalt.[16] Makromolekuly, jako je hematin, kobalamin, vitamin B12 a koenzym F430, se také používají pro dichlorování polychlorovaných ethylenů a benzenů. Charles a jeho spolupracovníci uvedli, že vitamin B12 a koenzym F430 jsou schopné postupně dechlorovat tetrachlorethen na eten, zatímco u hematinu bylo prokázáno, že tetrachlorethen dechloruje na vinylchlorid.[17]

Javier a jeho spolupracovníci uvedli syntézu komplexů fluoridu železitého. Komplexy byly poté použity jako prekurzory a prekatalyzátory pro hydrodefluoraci fluorovaných uhlovodíků. Uváděli první syntézu komplexu železa a fluoridu o třech souřadnicích.[18]

Jayant a jeho spolupracovníci vyvinuli dvoufázové systémy pro dehalogenaci trichlorethenů. Kinetický model poskytuje reakční proces, který probíhá v jedné fázi, zatímco přenos hmoty mezi dvěma fázemi.[19]Bylo provedeno několik zpráv o dehalogenačním procesu prováděných s použitím různých jiných kovů, jako je kobalt, nikl, palladium, křemík a germánium.[20][2][21]
Reference
- ^ Klein, U. Experimenty, modely, papírové nástroje: Kultury organické chemie v devatenáctém století, Stanford University Press: Kalifornie, 2003, 191-193
- ^ A b Moon, J .; Lee, S. (2009). "Palladiem katalyzovaná dehalogenace arylchloridů a bromidů pomocí fosfitových ligandů". J. Organomet. Chem. 694 (3): 473–477. doi:10.1016 / j.jorganchem.2008.10.052.
- ^ Ware, G .; Gunther, F. Recenze kontaminace životního prostředí a toxikologie, Springer-Verlag: New York, 1998, 155, 1-67.
- ^ A b C Trost, Barry M .; Fleming, Ian (1991). Komplexní organická syntéza - selektivita, strategie a účinnost v moderní organické chemii. 1–9. Elsevier. 793–809. ISBN 0080359299.
- ^ Ramón, D .; Yus, M. Maskované lithium-bišomoenoláty: Užitečné meziprodukty v organické syntéze, J. Org. Chem. 1991, 56, 3825-3831.
- ^ Guijarro, A .; Ramón, D .; Yus, M. Naftalenem katalyzovaná lithiace funkcionalizovaných chlorarenů: regioselektivní příprava a reaktivita funkcionalizovaných lithioarenů, Tetrahedron, 1993, 49, 469-482.
- ^ Yus, M .; Ramón, D. Arenem katalyzované lithiační reakce s lithiem při nízké teplotě, Chem. Comm. 1991, 398-400.
- ^ Hawari, J. Regioselektivita dechlorace: redukční dechlorace polychlorbifenylů polymethylhydrosiloxan-alkalickým kovem. J. Organomet. Chem. 1992, 437, 91-98.
- ^ Mackenzie, K .; Kopinke, F.-D. Debrominace duroplastických nehořlavých polymerů. Chemosphere, 1996, 33, 2423-2428.
- ^ Tarakanova, A .; Anisimov, A .; Egorov, A. Nízkoteplotní dehalogenace benzylhalogenidů atomovým hořčíkem ve stavu 3P. Russian Chemical Bulletin, 1999, 48, 147-151.
- ^ Aitken, R .; Hodgson, P; Oyewale, A. ‘Morrison, J. Dehalogenace organických halogenidů bleskovou vakuovou pyrolýzou na hořčík: univerzální syntetická metoda. Chem. Commun. 1997, 1163-1164.
- ^ Grushin, V .; Alper, H. Aktivace jinak nereaktivních vazeb C-Cl. Horní. Organomet. Chem. 1999, 3, 193-226.
- ^ Hirao, T .; Hirano, K .; Hasegawa, T .; Oshiro, Y .; Ikeda, I. Nový systém sestávající z nízkovalentního vanadu a diethylfosfonátu nebo triethylfosfitu pro vysoce stereoselektivní redukci gem-dibromcyklopropanů. J. Org. Chem. 1993, 58, 6529-6530
- ^ Eisch, J .; Alila, J. Dihydrid lithný chrom (I): nové činidlo pro všestrannou redukční metatezu, reduktivní cyklizaci, oligomerizaci nebo polymeraci různých organických substrátů. Organometallics, 2000, 19, 1211-1213
- ^ Cahiez, G .; Benard, D .; Normant, J. Reduction des halogenures vinyliques et aryliques par les organomagnesiens en přítomnost manganu (II). J. organomet. Chem. 1976, 113, 107-113
- ^ Fakhfakh, M .; Franck, X .; Hocquemiller, R. ‘Figadere, B. Hydrobromatizace 2-aryl-1,1-dibrom-1-alkenů katalyzovaná železem. J. Organomet. Chem. 2001, 624, 131-135
- ^ Gantzer, C .; Wackett, L. Redukční dichlorace katalyzovaná bakteriálními koenzymy přechodných kovů. Environ. Sci. Technol. 1991, 25, 715-722
- ^ Vela, J .; Smith, J; Yu, Y .; Ketterer, N .; Flaschenriem, C .; Lachicotte, R .; Holland, P. Syntéza a reaktivita komplexů fluoridu železitého s nízkou souřadnicí a jejich použití při katalytické hydrodefluoraci fluorovaných uhlovodíků. J. Am. Chem. Soc. 2005, 127, 7857-7870
- ^ Gotpagar, J .; Grulke, E .; Bhattacharyya, D .; Redukční dehalogenace trichlorethylenu: kinetické modely a experimentální ověření. J. Nebezpečná mat. 1998, 62, 3, 243-264
- ^ Hetflejš, J .; Czakkoova, M .; Rericha, R .; Vcelak, J. Katalyzovaná dehalogenace deloru 103 hydridoaluminátem sodným. Chemosphere 2001, 44, 1521.
- ^ Kagoshima, H .; Hashimoto, Y .; Oguro, D .; Kutsuna, T .; Saigo, K. Kombinace trofenylfosfin / chlorid germania: Nové činidlo pro redukci derivátů kyseliny α-bromkarboxylové. Tetrahedron, 1998, 39, 1203-1206
