Komplex Creutz – Taube - Creutz–Taube complex
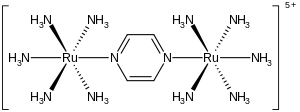
The Creutz – Taube ion je kovový komplex se vzorcem {[Ru (NH3 )5]2(C4H4N2)}5+. Tento kationický druh byl intenzivně studován ve snaze porozumět intimním detailům elektronový přenos vnitřní koule, tedy jak elektrony přejít z jednoho kovového komplexu do druhého. Ion je pojmenován po Carol Creutz, která komplex nejprve připravila, a její vedoucí práce Henry Taube, který obdržel Nobelova cena za chemii pro toto a související objevy elektronového přenosu.[1][2]
Vlastnosti
Komplex se skládá ze dvou pentamminruthenium jednotky spojené s atomy dusíku v přemostění pyrazin ligand, který doplňuje oktaedrický koordinační sféra každého kovu. Důležitým rysem této sloučeniny je to, že oba kovy mají zjevné frakční oxidační stavy +2,5. Normálně mají kovové ionty, stejně jako většina iontů, integrální oxidační stavy. Například komplexy ruthenia a aminu jsou obvykle +2 nebo +3. Skutečnost, že oxidační stavy jsou polointegrální, naznačuje, že dva Ru (NH3)5 centra jsou ekvivalentní, pokud jde o jejich počet elektronů. Krystalografické a teoretické studie jsou v souladu s tímto popisem, to znamená, že dvě kovová centra jsou ekvivalentní.[3][4] Tento iont, charakteristický pro komplex smíšené valence, silně absorbuje světlo v části infračervené oblasti blízké infračervenému záření elektromagnetické spektrum. V případě iontu Creutz – Taube nastává absorpční maximum na 1570nm. Tato absorpce je popsána jako intervalové pásmo přenosu náboje.
Syntéza
Ion byl původně izolován jako hydratovaný tosylát sůl [Ru (NH3)5]2(C4H4N2)(Ó3SC6H4CH3)5· 3H2O. Připravuje se ve dvou krocích prostřednictvím pyrazinového komplexu Ru (III) -Ru (III) :.[3]
- 2 [Ru (NH3)5Cl]2+ + C.4H4N2 → {[Ru (NH3)5]2(C4H4N2)}6+ + 2 Cl−
- 2 {[Ru (NH3)5]2(C4H4N2)}6+ + Zn → 2 {Ru (NH3)5]2(C4H4N2)}5+ + Zn2+
Ion Creutz – Taube ilustruje výhody komplexů ruthenia pro zkoumání redoxních reakcí. Ionty Ru (II) a Ru (III) mohou být při mírné přeměně redoxní potenciály. Oba tyto oxidační stavy jsou kineticky inertní. Mnoho analogů tohoto iontu bylo připraveno za použití různých můstkových ligandů.
Reference
- ^ Creutz, C .; Taube, H. (1969). „Přímý přístup k měření bariéry Franck-Condon k přenosu elektronů mezi kovovými ionty“. Journal of the American Chemical Society. 91: 3988–3989. doi:10.1021 / ja01042a072.
- ^ Taube, Henry (8. prosince 1983). „Přenos elektronů mezi kovovými komplexy“ (PDF). Nobelova přednáška.
- ^ A b Fürholz, U .; Joss, S .; Bürgi, H. B .; Ludi, A. (1985). „Revidovaný komplex Creutz – Taube: krystalografická studie řady elektronových přenosů (μ-pyrazin) dekaamminediruthenium ([(NH3)5Ru (Pyz) Ru (NH3)5]n+ (n = 4–6))". Anorganická chemie. 24: 943–948. doi:10.1021 / ic00200a028.
- ^ Demadis, K. D .; Hartshorn, C. M .; T. J., Meyer (2001). „Přechod lokalizovaný na delokalizovaný v chemii smíšené valence“. Chemické recenze. 101 (9): 2655–2686. doi:10,1021 / cr990413m.
