Boroxin - Boroxine
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC 2,4,6-trihydroxy-l, 3,5,5,4,4,6-trioxatriborinan | |
| Ostatní jména Trihydroxyboroxin, cyklotriboroxan | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| B3H3Ó3 | |
| Molární hmotnost | 83,455 g mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Boroxin (B3H3Ó3) je šestičlenný, heterocyklická sloučenina složený ze střídání kyslík a jednotlivě hydrogenovaný bór atomy. Deriváty boroxinu (boronové anhydridy ), jako je trimethylboroxin a trifenylboroxin, také tvoří širší třídu sloučenin nazývaných boroxiny.[1] Tyto sloučeniny jsou pevné látky, které jsou obvykle v rovnováze s jejich příslušnými látkami boronové kyseliny pokojová teplota.[1][2][3] Kromě použití v teoretických studiích se boroxin používá především při výrobě optiky.[4]
Struktura a lepení
Tři souřadnicové sloučeniny boru obvykle vykazují trigonální rovinnou geometrii, proto je boroxinový kruh také uzamčen v rovinné geometrii.[2][5] Tyto sloučeniny jsou izoelektronické vůči benzenu. S prázdným p-orbitálem na atomech boru mohou mít určitý aromatický charakter.[2][6] Jednoduché vazby boru na sloučeninách boroxinu jsou většinou s-charakteru.[5] Ethyl-substituovaný boroxin má délky vazeb B-O 1,384 Á a délky vazeb B-C 1,565 Á.[6] Fenylem substituovaný boroxin má podobné délky vazeb 1,386 Á, respektive 1,546 Á, což ukazuje, že substituent má malý vliv na velikost boroxinového kruhu.[6]
Substituce na boroxinovém kruhu určují jeho krystalovou strukturu. Alkylem substituované boroxiny mají nejjednodušší krystalovou strukturu. Tyto molekuly se skládají na sebe a srovnávají atom kyslíku z jedné molekuly s atomem boru v jiné, přičemž každý atom boru je mezi dvěma dalšími atomy kyslíku. Tím se vytvoří trubice z jednotlivých boroxinových kruhů. Intermolekulární vzdálenost B-O ethyl-substituovaného boroxinu je 3,462 Á, což je mnohem delší než vzdálenost vazby B-O 1,384 Á. Krystalová struktura fenylem substituovaného boroxinu je složitější. Interakce mezi prázdnými p-orbitály v atomech boru a π-elektrony v aromatických, fenylových substituentech způsobují odlišnou krystalovou strukturu. Boroxinový kruh jedné molekuly je naskládán mezi dva fenylové kruhy jiných molekul. Toto uspořádání umožňuje fenylovým substituentům darovat hustotu elektronů n na prázdné p-orbitaly boru.[6]
Syntéza
Jak bylo zjištěno ve třicátých letech minulého století, boroxiny se vyrábějí z jejich odpovídajících boronových kyselin dehydratací.[1][2][3] Tuto dehydrataci lze provést buď sušicím prostředkem, nebo zahříváním pod vysokým vakuem.[2] Novější syntéza trimethylboroxinu zahrnuje reakci kysličník uhelnatý s borane (B2H6) a borohydrid lithný (LiBH4) jako katalyzátor:[5]
Reakce
Trimethylboroxin se používá při methylaci různých arylhalogenidů palladium -katalyzovaný Spojka Suzuki-Miyaura reakce:[7]
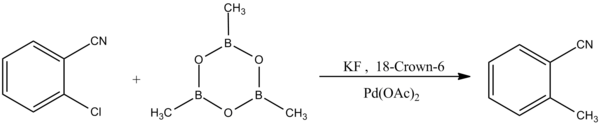
Další forma Suzukiho-Miyaurovy vazebné reakce vykazuje selektivitu k arylchloridům:[8]
Boroxiny byly také zkoumány jako prekurzory monomerních oxoboran, HB≡O.[3] Tato sloučenina se rychle převádí zpět na cyklický boroxin, a to i při nízkých teplotách.[3]
Reference
- ^ A b C Brown, H.C. Borany v organické chemii; Cornell University Press: Ithaca, 1972; str. 346–347.
- ^ A b C d E Hall, Dennis G. (2005). Kyseliny borité - příprava a aplikace v organické syntéze a medicíně. John Wiley & Sons ISBN 3-527-30991-8.
- ^ A b C d Westcott, S.A. (2010). „BO Chemistry Comes Full Circle“. Angewandte Chemie International Edition. 49 (48): 9045–9046. doi:10,1002 / anie.201003379. PMID 20878818.
- ^ Wu, Q.G .; G. Wu; L. Leon Branca; S. Wang (1999). „B3O3Ph3 (7-azaindol): Struktura, luminiscence a fluxionality“. Organometallics. 18 (13): 2552–2556. doi:10.1021 / om990053t.
- ^ A b C Onak, T. v Organoborane Chemistry; Maitles, P.M., Stone, F.G.A., West, R., Eds .; Academic Press: New York, 1975; str. 2,4,16,44.
- ^ A b C d Haberecht, M.C .; Bolte, Michael; Wagner, Matthias; Lerner, Hans-Wolfram (2005). „Nový polymorf Tri (p-tolyl) boroxin ". Journal of Chemical Crystallography. 35 (9): 657–665. doi:10.1007 / s10870-005-3325-r.
- ^ Gray, M .; Andrews, I.P .; Hook, D.F .; Kitteringham, J .; Voyle, M. (2000). "Praktická methylace arylhalogenidů pomocí Suzuki-Miyaura Coupling". Čtyřstěn. 41 (32): 6237–6240. doi:10.1016 / S0040-4039 (00) 01038-8.
- ^ Song, C .; Smět.; Chai, Q .; Ma, C .; Jaing, W .; Andrus, M.B. (2005). „Palladium katalyzované Suzuki-Miyaura spojení s arylchloridy za použití objemného fenantryl-N-heterocyklického karbenového ligandu“. Čtyřstěn. 61 (31): 7438–7446. doi:10.1016 / j.tet.2005.05.071.

![{displaystyle {ce {3CO}} + 1,5 overbrace {{ce {B2H6}}} ^ {{ce {borane}}} {ce {-> [{ce {LiBH4}}] (CH3BO) 3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ee286ea4c51b8daa42b23978ee38f50f525d2e8)
![{displaystyle {ce {{overset {(X = Br, I)} {C6H5X}} + (CH3BO) 3 -> [{ce {K2CO3, Pd (PPh3) 4}}] [{ce {dioxane}}] C6H5CH3 }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e07d87468caf83dee3007f299bb75ed8928deb4b)