Amoniak (datová stránka) - Ammonia (data page)
Tato stránka poskytuje doplňující chemické údaje o amoniak.
Struktura a vlastnosti
| Molekulární struktura | |
|---|---|
| Skupina bodů | C3v |
| Délka vazby | 101.2 odpoledne (N – H)[1] |
| Úhel vazby | 106,7 ° (H – N – H)[1] |
| Síla vazby | 435 kJ / mol (H – NH2) |
| Crystal data | |
| Krystalická struktura | ? |
| Vlastnosti | |
| Dipólový moment | 1.46 D |
| Dielektrická konstanta | 22 ε0 při 239 K. |
| Magnetická susceptibilita | diamagnetický |
| Kyselost NH4+ (pK.A ) | 9.25 |
Termodynamické vlastnosti
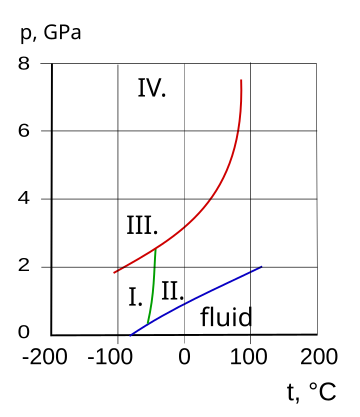
Fázový diagram a krystalické stavy amoniaku
I. kubický, II. hcp, III. FCC, IV. ortorombický
I. kubický, II. hcp, III. FCC, IV. ortorombický
| Fázové chování | |
|---|---|
| Trojitý bod | 195,4 K (–77,75 ° C), 6,060 kPa |
| Kritický bod | 405,5 K (132,3 ° C), 11 300 M.Pa |
| Standardní změna entalpie fúze, ΔfusH | +5,653 kJ / mol |
| Standardní změna entropie fúze, ΔfusS | +28,93 J / (mol · K) |
| Standardní změna entalpie odpařování, ΔvapH | +23,35 kJ / mol při BP -33,4 ° C |
| Standardní změna entropie odpařování, ΔvapS | +97,41 J / (mol · K) při BP -33,4 ° C |
| Solidní vlastnosti | |
| Standardní změna entalpie formace, ΔFH | ? kJ / mol |
| Standardní molární entropie, S | ? J / (mol K) |
| Tepelná kapacita, Cp | ? J / (mol K) |
| Vlastnosti kapaliny | |
| Standardní změna entalpie formace, ΔFH | ? kJ / mol |
| Standardní molární entropie, S | ? J / (mol K) |
| Tepelná kapacita, Cp | 80,80 J / (mol K) |
| Vlastnosti plynu | |
| Standardní změna entalpie formace, ΔFH | -45,92 kJ / mol |
| Std Gibbsova volná energie změna formace, ΔFG | -16,6 kJ / mol |
| Standardní molární entropie, S | 192,77 J / (mol K) |
| Tepelná kapacita, Cp | 35,06 J / (mol K) |
| Poměr tepelné kapacity, y při 15 ° C | 1.310 |
| van der Waalsovy konstanty | a = 422,5 litru2 kPa / mol2 b = 0,03707 litrů / mol |
Údaje o rovnováze pára-kapalina
| P v mm Hg | 1 | 10 | 40 | 100 | 400 | 760 | 1520 | 3800 | 7600 | 15600 | 30400 | 45600 | |
| T ve ° C | −109.1(s) | −91.9(s) | −79.2(s) | −68.4 | −45.4 | −33.6 | −18.7 | 4.7 | 25.7 | 50.1 | 78.9 | 98.3 | |
Tabulka (výše) získaná z CRC Handbook of Chemistry and Physics 44. vyd. Zápis (y) označuje rovnovážnou teplotu páry nad pevnou látkou. Jinak je teplota rovnováhou páry nad kapalinou.
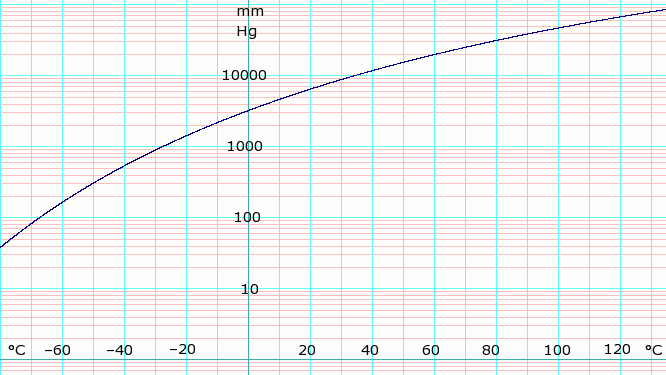
log10 jakéhokoli tlaku par čpavku. Používá vzorec uvedený níže.
Vzorec pro tlak páry pro amoniak:[2]
- log10P = A – B / (T − C),
kde P je tlak v kPa, a T je teplota v kelvinů;
- A = 6.67956, B = 1002.711, C = 25,215 pro T = 190 K až 333 K.
| 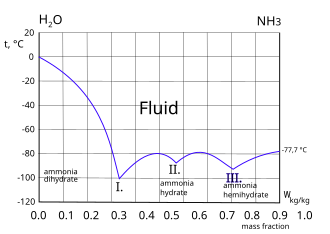 Mrznoucí křivka systému amoniak-voda. Tři eutektické body I. II. a III. jsou ukázány. Zmrazenou složkou nalevo od I. bodu je led. Právo III. bod zmrazené složky je amoniak.[4]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tepelná kapacita kapaliny a páry
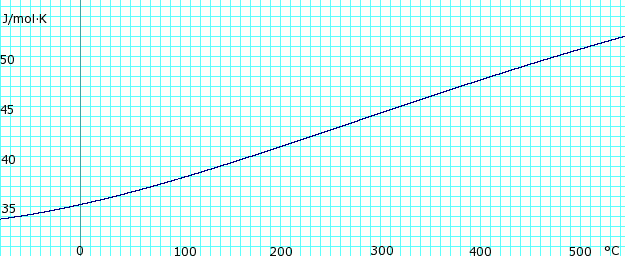 Tepelná kapacita, Cpbezvodého plynného amoniaku. Používá polynom získaný z CHERIC.[6] |
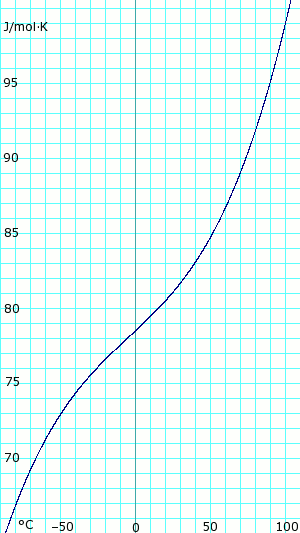 Tepelná kapacita bezvodého kapalného amoniaku. Používá polynom získaný z CHERIC.[6] |
Spektrální data
| UV-Vis | |
|---|---|
| λmax | Žádný nm |
| Koeficient vyhynutí, ε | Žádný |
| IR | |
| Hlavní absorpční pásma | 3444, 3337, 1627, 950 cm−1 |
| NMR | |
| Protonová NMR | |
| Uhlík-13 NMR | Žádné - žádné uhlíky |
| Další údaje NMR | |
| SLEČNA | |
| Mše hlavní fragmenty | 17 (100%) 16(80%) 15(9%) |
Regulační údaje
| Regulační údaje | |
|---|---|
| Číslo EINECS | 231-635-3 (plyn) 215-647-6 (soln.) |
| Indexové číslo EU | 007-001-00-5 (plyn) 007-001-01-2 (soln.) |
| PEL-TWA (OSHA ) | 50 ppm (35 mg / m3) |
| IDLH (NIOSH ) | 300 ppm |
| Bod vzplanutí | 11 ° C |
| teplota samovznícení | 651 ° C |
| Výbušné limity | 15–28% |
| RTECS # | BO0875000 |
Bezpečnostní list
Při manipulaci s touto chemikálií může dojít k významným bezpečnostním opatřením ... Důrazně doporučujeme vyhledat si bezpečnostní list (BL ) pro tuto chemickou látku ze spolehlivého zdroje a postupujte podle jejích pokynů.
Reference
- Linstrom, Peter J .; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, Národní institut pro standardy a technologii, Gaithersburg (MD), http://webbook.nist.gov
- ^ A b CRC Handbook of Chemistry and Physics, 94. vydání. http://www.hbcpnetbase.com. Strana 9-26. Vyvolány 18 June 2013.
- ^ Lange's Handbook of Chemistry, 10. vydání. strana 1436.
- ^ Lange's Handbook of Chemistry, 10. vydání. stránky 1451 a 1468.
- ^ Friedrich Merkelová, Franjo Bošnjaković (1929). Diagramme und Tabellen zur Berechnung der Absorptions-Kältemachienen. Berlín: Julius Springer. str. 46.
- ^ Perman, Jour. Chem. Soc. 83 1168 (1903).
- ^ A b "Vlastnosti čistých komponent" (Dotazovatelná databáze). Informační centrum pro výzkum chemického inženýrství. Archivováno z původního dne 3. června 2007. Citováno 1. června 2007.
Pokud není uvedeno jinak, údaje se týkají standardní teplota a tlak okolí.
Zřeknutí se odpovědnosti platí.
externí odkazy
- IR spektrum (z NIST )
